题目内容
A、B、C是三种短周期元素,它们的原子序数依次增大.A元素原子形成的离子就是一个质子;C元素是地壳中含量最多的元素;B元素的两种气态氧化物以等物质的量混合后,气体的平均相对分子质量为36.
回答下列问题:
(1)写出B元素的符号 .
(2)将3.6g B单质在足量C单质中完全燃烧,所得气体通入1L 0.4mol/L的NaOH溶液,完全吸收.此过程用一个离子方程式可表示为 .
(3)A元素的单质与C元素的单质可制成化学电源--燃料电池,电池以浓氢氧化钠溶液为电解液,以惰性金属为电极,则通入A单质的一极为电池 极,该电极的电极反应式为 .通入C单质的一极为电池的另一个电极,其电极反应式为 .已知每生成1mol液态A2C放出286kJ热量,写出该电池工作原理的热化学方程式 .
回答下列问题:
(1)写出B元素的符号
(2)将3.6g B单质在足量C单质中完全燃烧,所得气体通入1L 0.4mol/L的NaOH溶液,完全吸收.此过程用一个离子方程式可表示为
(3)A元素的单质与C元素的单质可制成化学电源--燃料电池,电池以浓氢氧化钠溶液为电解液,以惰性金属为电极,则通入A单质的一极为电池
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C是三种短周期元素,它们的原子序数依次增大.A元素原子形成的离子就是一个质子,则A为H元素;C元素是地壳中含量最多的元素,则C是O元素;B元素的两种气态氧化物以等物质的量混合后,气体的平均相对分子质量为36,则B为C元素;据此可以解答.
解答:
解:A、B、C是三种短周期元素,它们的原子序数依次增大.A元素原子形成的离子就是一个质子,则A为H元素;C元素是地壳中含量最多的元素,则C是O元素;B元素的两种气态氧化物以等物质的量混合后,气体的平均相对分子质量为36,则B为C元素;据此可以解答.
(1)由上述分析,B为碳元素,符号为C,故答案为:C;
(2)3.6g C单质为0.3mol,则0.3molCO2与0.4molNaOH反应的离子方程式为:3CO2+4OH-=CO32-+2HCO3-+H2O,故答案为:3CO2+4OH-=CO32-+2HCO3-+H2O;
(3)在碱性条件下,氢氧燃料电池中,通入H2的为负极;电极反应式为H2+2OH-+2e-=H2O;O2在正极反应,反应式为O2+2H2O+4e-=4OH-;每生成1mol液态H2O放出286kJ热量,则该反应的热化学方程式;H2(g)+
O2 (g)=H2O(l)△H=-286KJ?mol-1,
故答案为:负; H2+2OH-+2e-=H2O;O2+2H2O+4e-=4OH-;H2(g)+
O2 (g)=H2O(l)△H=-286KJ?mol-1.
(1)由上述分析,B为碳元素,符号为C,故答案为:C;
(2)3.6g C单质为0.3mol,则0.3molCO2与0.4molNaOH反应的离子方程式为:3CO2+4OH-=CO32-+2HCO3-+H2O,故答案为:3CO2+4OH-=CO32-+2HCO3-+H2O;
(3)在碱性条件下,氢氧燃料电池中,通入H2的为负极;电极反应式为H2+2OH-+2e-=H2O;O2在正极反应,反应式为O2+2H2O+4e-=4OH-;每生成1mol液态H2O放出286kJ热量,则该反应的热化学方程式;H2(g)+
| 1 |
| 2 |
故答案为:负; H2+2OH-+2e-=H2O;O2+2H2O+4e-=4OH-;H2(g)+
| 1 |
| 2 |
点评:本题考查了学生利用元素周期表及原子结构进行元素推断,同时进一步考查了学生对元素化合物的性质的掌握情况,有一定的综合性,在答题时还要学生注意化学用语的正确书写.

练习册系列答案
相关题目
在强酸性溶液中能大量共存的无色透明离子组是( )
| A、K+、Na+、NO3-、MnO4- |
| B、Mg2+、Na+、Cl-、SO42- |
| C、K+、Na+、Br-、Cu2+ |
| D、Na+、Ba2+、OH-、SO42- |
使用酸碱中和滴定的方法,用0.1000mo1?L-1盐酸滴定锥形瓶中未知浓度的NaOH溶液,下列操作会使测定结果偏低的是( )
| A、用酸式滴定管量取0.1000 mol?L-1盐酸时,酸式滴定管经蒸馏水洗净后未用0.1000mo1?L-1盐酸润洗 |
| B、滴定前平视读数,滴定结束时俯视读数 |
| C、滴定前滴定管下端尖嘴没有气泡,滴定后读数时发现滴定管下端尖嘴有气泡 |
| D、用未知浓度的Na0H待测液润洗锥形瓶 |
下列有关实验操作说法中,正确的是( )
①用pH试纸测得氯水的pH为2
②用量筒、试管胶头滴管、玻璃棒、蒸馏水和pH试纸,可鉴别pH相等的硫酸和醋酸
③在进行分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
④用碱式滴定管量取25.00mL溴水
⑤可用渗析的方法除去淀粉中混有的少量NaCl杂质
⑥在进行过滤操作时,为了加快速率,可用玻璃棒不断搅拌过滤器中液体.
①用pH试纸测得氯水的pH为2
②用量筒、试管胶头滴管、玻璃棒、蒸馏水和pH试纸,可鉴别pH相等的硫酸和醋酸
③在进行分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
④用碱式滴定管量取25.00mL溴水
⑤可用渗析的方法除去淀粉中混有的少量NaCl杂质
⑥在进行过滤操作时,为了加快速率,可用玻璃棒不断搅拌过滤器中液体.
| A、①③⑤ | B、②③⑤ |
| C、③④⑤ | D、①③④⑥ |
下列实验基本操作中不正确的是( )
| A、用量筒量取液体时,视线与量筒内液体凹液面最低处保持水平 |
| B、稀释浓硫酸时,把浓硫酸慢慢倒入盛有水的烧杯中并搅拌 |
| C、用胶头滴管向试管中加入液体时,胶头滴管紧贴试管内壁 |
| D、用托盘天平称量物质时,称量物放在左盘,砝码放在右盘 |
 已知可逆反应:mA(g)+nB(1)?pC(g).改变温度(其他条件不变)、压强(其他条件不变)对上述反应正逆反应速率的影响分别如图所示,以下叙述正确的是( )
已知可逆反应:mA(g)+nB(1)?pC(g).改变温度(其他条件不变)、压强(其他条件不变)对上述反应正逆反应速率的影响分别如图所示,以下叙述正确的是( )| A、m>p,正反应为放热反应 |
| B、m<p,正反应为吸热反应 |
| C、m+n<p,正反应为放热反应 |
| D、m+n<p,正反应为吸热反应 |
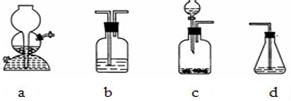 为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应.
为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应.