题目内容
11.汽车尾气的主要成分有CO、SO2、NO、NO2等.(1)利用氨水可以将SO2、NO2吸收,原理如图1所示.
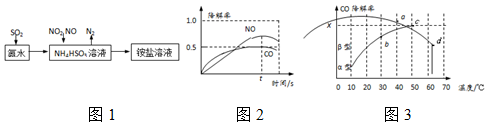
请写出NO2被吸收反应的离子方程式2NO2+4HSO3-═N2+4SO42-+4H+.
(2)科研工作者目前正在尝试以二氧化钛(TiO2)催化分解汽车尾气的研究.
①已知:
反应Ⅰ:Ⅰ:2NO(g)+O2(g)═2NO2(g)△H1 =-113.0 kJ•molˉ1
反应Ⅱ:2SO2(g)+O2(g)═2SO3(1)△H2 =-288.4 kJ•molˉ1
反应Ⅲ:3NO2(g)+H2O(g)═2HNO3+2NO(g)△H3 =-138.0 kJ•molˉ1
则反应NO2(g)+SO2(g)═NO(g)+SO3(1)△H4=-87.7 kJ/mol
②已知TiO2催化尾气降解原理可表示为:
2CO(g)+O2(g)?2CO2(g)△H5;
2H2O(g)+4NO(g)+3O2(g)?4HNO3(g)△H6.
在O2、H2O(g)浓度一定条件下,模拟CO、NO的降解,得到其降解率(即转化率)如图2所示.请解释t s后NO降解率下降的可能原因随着反应的进行,可能发生反应2NO=N2+O2生成氮气,NO浓度降低,使平衡2H2O+4NO+3O2?4HNO3向逆反应方向移动.
(3)沥青混凝土也可降解CO.图3为在不同颗粒间隙的沥青混凝土(α、β型)在不同温度下,反应相同时间,测得CO降解率变化.结合图2回答下列问题:
①已知在50℃时在α型沥青混凝土容器中,平衡时O2浓度为00.01mol•L-1,求此温度下CO降解反应的平衡常数$\frac{100{x}^{2}}{(1-x)^{2}}$.
②下列关于图2的叙述正确的是BC
A.降解率由b点到c点随温度的升高而增大,可知CO降解反应的平衡常数Kb<Kc
B.相同温度下β型沥青混凝土中CO降解速率比α型要大
C.d点降解率出现突变的原因可能是温度升高后催化剂失效
③科研团队以β型沥青混凝土颗粒为载体,将TiO2改为催化效果更好的TiO2纳米管,在10℃~60℃范围内进行实验,请在图2中用线段与“
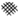 ”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围
”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围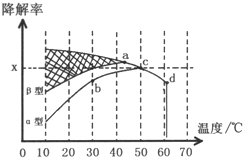 .
.(4)TiO2纳米管的制备是在弱酸性水溶液中以金属钛为阳极进行电解,写出阳极的电极反应式Ti-4e-+2H2O=TiO2+4H+.
分析 (1)根据流程图知,NO2与NH4HSO3反应,+4价的氮氧化+4价的硫,NO2被NH4HSO3吸收生成N2,NO2得电子被还原,则HSO3-被氧化生成SO42-,据此书写离子方程式;
(2)①根据已知方程式构建目标方程式,根据盖斯定律计算反应热;
②根据平衡移动原理来分析,减少反应物浓度,平衡逆向移动;
(3)①化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值;
②A.平衡常数是温度的函数,温度升高向吸热方向进行,即向逆反应方向进行;
B.相同温度下β型沥青混凝土中CO降解速率比α型要大;
C.d点降解率出现突变的原因可能是温度升高后催化剂失效;
③据催化剂能加快化学反应速率,但不影响平衡移动画图;
(4)据阳极失去电子发生氧化反应书写电极反应方程式.
解答 解:(1)根据流程图知,NO2被NH4HSO3吸收生成N2,N元素化合价由+4价变为0价,NO2得电子被还原,则HSO3-失电子被氧化,被氧化生成SO42-,反应的方程式为:4NH4HSO3+2NO2=N2+4NH4HSO4,离子方程式为2NO2+4HSO3-═N2+4SO42-+4H+,
故答案为:2NO2+4HSO3-═N2+4SO42-+4H+;
(2)①反应Ⅰ:2NO(g)+O2(g)═2NO2(g)△H1 =-113.0 kJ/mol
反应Ⅱ:2SO2(g)+O2(g)═2SO3(1)△H2 =-288.4 kJ/mol
根据盖斯定律(Ⅱ-Ⅰ)×$\frac{1}{2}$得反应NO2(g)+SO2(g)═NO(g)+SO3(1),则△H4=[(-288.4 kJ/mol)-(-113.0 kJ/mol)]×$\frac{1}{2}$=-87.7 kJ/mol
故答案为:-87.7 kJ/mol;
②可能的原因是t s后发生反应2NO=N2+O2生成氮气,并且NO浓度降低,2H2O+4NO+O2?4HNO3平衡逆向移动,造成HNO3浓度降低,
故答案为:随着反应的进行,可能发生反应2NO=N2+O2生成氮气,NO浓度降低,使平衡2H2O+4NO+3O2?4HNO3向逆反应方向移动;
(3)①CO的降解率为x,设起始CO浓度为1mol/L,
2CO(g)+O2(g)?2CO2(g)
开始(c) 1 0
变化 x $\frac{1}{2}$x x
平衡 1-x 0.1 x,
k=$\frac{{c}^{2}(C{O}_{2})}{{c}^{2}(CO)c({O}_{2})}$=$\frac{{x}^{2}}{0.{1}^{2}×(1-x)^{2}}$=$\frac{100{x}^{2}}{(1-x)^{2}}$,
故答案为:$\frac{100{x}^{2}}{(1-x)^{2}}$;
②A.平衡常数是温度的函数,温度升高向吸热方向进行,即向逆反应方向进行,k=$\frac{{c}^{2}(C{O}_{2})}{{c}^{2}(CO)c({O}_{2})}$,故k减小,即Kb>Kc,故A错误;
B.由图得,相同温度下β型沥青混凝土中CO降解速率比α型要大,故B正确;
C.d点降解率出现突变的原因可能是温度升高后催化剂失效,故C正确;
故答案为:BC;
③据催化剂能加快化学反应速率,但不影响平衡移动,故图为 ,
,
故答案为: ;
;
(4)阳极失去电子发生氧化反应,故电极反应方程式为Ti-4e-+2H2O=TiO2+4H+,
故答案为:Ti-4e-+2H2O=TiO2+4H+.
点评 本题考查反应热的计算、平衡移动原理的应用,平衡常数,电极反应方程式的书写等知识,注意平衡移动原理的应用,该题难点为(3)②作图,本题难度中等.

| A. | 尼龙绳 | B. | 宣纸 | C. | 羊绒衫 | D. | 棉衬衣 |
| A. | 浓度均为0.1 mol•L-1的 HCOONa和NH4Cl 溶液中阳离子的物质的量浓度之和:前者大于后者 | |
| B. | 用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等 | |
| C. | 0.2 mol•L-1 HCOOH 与 0.1 mol•L-1 NaOH 等体积混合后的溶液中:c(HCOO-)+c(OH-)=c(HCOOH)+c(H+) | |
| D. | 0.2 mol•L-1 CH3COONa 与 0.1 mol•L-1盐酸等体积混合后的溶液中(pH<7):c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |
| A. | 第一电离能:C<O<N | B. | 电负性:C>N>O | ||
| C. | 热稳定性:HF>H2O>H2S | D. | 酸性:HCl<HBr<HI |
| A. | HOCH2CH=CH2能发生取代反应,加成反应、氧化反应 | |
| B. | 月桂烯(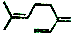 )所有碳原子一定在同一平面上 )所有碳原子一定在同一平面上 | |
| C. | 甲烷、乙烯、苯和乙醇都能使酸性KMnO4溶液褪色 | |
| D. | 油脂皂化反应得到高级脂肪酸与甘油 |
| A. | 活性炭具有还原性,可用作冰箱除味剂 | |
| B. | 二氧化硫具有氧化性,可用作造纸漂白剂 | |
| C. | Al2O3具有很高的熔点,可用于制造熔融烧碱的坩埚 | |
| D. | FeCl3溶液能与Cu反应,可用于蚀刻印刷电路板 |
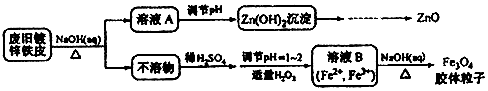
己知:Zn及其化合物的性质与Al及其化合物的性质相似.下列相关说法错误的是( )
| A. | 用NaOH溶液处理废旧镀锌铁皮的作用是去除油污、溶解镀锌层 | |
| B. | 调节溶液A的pH产生Zn(OH)2沉淀,经抽滤、洗涤、灼烧即可制得ZnO | |
| C. | 由溶液B制得Fe3O4胶体粒子的过程中,须持续通N2,其原因是防止Fe2+被氧化 | |
| D. | Fe3O4胶体粒子能用减压过滤法实现固液分离 |

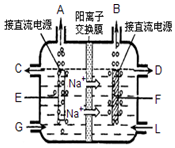 食盐是日常生活必需品,也是重要的化工原料.
食盐是日常生活必需品,也是重要的化工原料.