题目内容
6.根据元素周期律和物质结构的有关知识,以下有关排序错误的是( )| A. | 第一电离能:C<O<N | B. | 电负性:C>N>O | ||
| C. | 热稳定性:HF>H2O>H2S | D. | 酸性:HCl<HBr<HI |
分析 A.非金属性越强,第一电离能越大,且N的2p电子半满为稳定结构;
B.非金属性越强,电负性越大;
C.非金属性越强,对应氢化物越稳定;
D.卤族元素中,随着原子序数的增大得电子能力逐渐减弱、氢化物的酸性逐渐增强.
解答 解:A.非金属性越强,第一电离能越大,且N的2p电子半满为稳定结构,则第一电离能:C<O<N,故A正确;
B.非金属性C<N<O,则电负性为C<N<O,故B错误;
C.非金属性F>O>S,对应氢化物稳定性HF>H2O>H2S,故C正确;
D.同主族元素随着原子序数的增大,氢化物的酸性逐渐增强,所以酸性:HI>HBr>HCl,故D正确.
故选B.
点评 本题考查元素周期律和周期表的应用,为高频考点,把握元素的位置、性质、元素周期律等为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
11.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,足量Fe与22.4 L Cl2反应,转移的电子数为2NA | |
| B. | 0.1molO2完全反应时,转移的电子数一定为 0.4 NA | |
| C. | 用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为 0.2NA | |
| D. | 常温常压下,100 g 17% H2O2水溶液中含氧原子总数为NA |
3.下列指定反应的离子方程式正确的是( )
| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 电解饱和食盐水获取烧碱和氯气:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 向氢氧化钡溶液中加入稀硫酸:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO3-+OH-═CaCO3↓+H2O |
1.可逆反应2A(g)→B(g)在一定条件下达平衡后,其他条件不变只把体积缩小一半,下列说法错误的是( )
| A. | 平衡正向移动 | B. | B的浓度增大 | C. | A的浓度减小 | D. | 逆反应速率加快 |
18.下列实验中,操作和现象以及对应结论都正确且现象与结论具有因果关系的是( )
| 选项 | 操作和现象 | 结论 |
| A. | 滴有酚酞的Na2CO3溶液中加入BaCl2溶液,红色变浅 | Na2CO3溶液中存在水解平衡 |
| B. | 向电石中加入饱和食盐水制乙炔,并将产生的气体直接填入酸性高锰酸钾溶液中,溶液紫红色褪去 | 记明乙炔能被酸性高锰酸钾氧化 |
| C. | 常温下,测得饱和Na2S溶液的PH大于饱和Na2CO3溶液 | 常温下水解程度:S2->CO32- |
| D. | 向分液漏斗中加入碘水后再加入CCl4,充分振荡,分层,且上层溶液至紫色 | CC14可作为碘的萃取剂 |
| A. | A | B. | B | C. | C | D. | D |
1.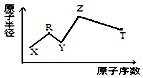 现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡,五种元素的原子半径与原子序数的关系如图所示,下列推断正确的是( )
现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡,五种元素的原子半径与原子序数的关系如图所示,下列推断正确的是( )
 现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡,五种元素的原子半径与原子序数的关系如图所示,下列推断正确的是( )
现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡,五种元素的原子半径与原子序数的关系如图所示,下列推断正确的是( )| A. | 原子半径和离子半径均满足:Y<Z | |
| B. | Y的单质易与R、T的氢化物反应 | |
| C. | 最高价氧化物对应的水化物的酸性:T<R | |
| D. | 由X、R、Y、Z四种元素组成的化合物水溶液一定显碱性 |

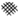 ”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围
”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围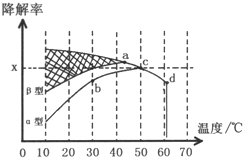 .
.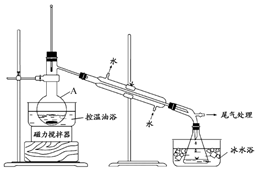 1-溴丙烷是一种重要的有机合成中间体,沸点为71℃,密度为1.36g•cm-3.实验室制备少量1-溴丙烷的主要步骤如下:
1-溴丙烷是一种重要的有机合成中间体,沸点为71℃,密度为1.36g•cm-3.实验室制备少量1-溴丙烷的主要步骤如下: