题目内容
16.下列生活用品中主要由合成纤维制造的是( )| A. | 尼龙绳 | B. | 宣纸 | C. | 羊绒衫 | D. | 棉衬衣 |
分析 宣纸、棉衬衣的主要成分为纤维素,羊绒衫的主要成分为蛋白质,只有尼龙绳主要成分为聚酯类合成纤维,据此进行解答.
解答 解:A.尼龙绳的主要成分是聚酯类合成纤维,满足条件,故A正确;
B.宣纸的主要成分为天然纤维素,不属于合成纤维,故B错误;
C.羊绒衫的主要成分是蛋白质,不属于合成纤维,故C错误;
D.棉衬衣的主要成分为天然纤维素,不是合成纤维,故D错误;
故选A.
点评 本题考查常见高分子材料的分类及应用,题目难度不大,明确常见有机物组成、性质及分类为解答关键,注意掌握合成纤维与纤维素、蛋白质等区别.

练习册系列答案
相关题目
7.下列有关离子方程式书写正确的是( )
| A. | Na2CO3溶液除去锅炉中水垢(CaSO4):Ca2++CO32-═CaCO3↓ | |
| B. | 用惰性电极电解饱和硫酸铜溶液:2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+ | |
| C. | 铝溶于氢氧化钠溶液:Al+2OH-+H2O=AlO2-+2H2↑ | |
| D. | 用H2O2从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH- |
8.下列有关化学用语表示正确的是( )
| A. | 中子数为18的硫原子:${\;}_{16}^{34}$S | B. | S2-的结构示意图: | ||
| C. | 过氧化氢的电子式:H+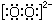 H+ H+ | D. | 葡萄糖的结构简式:C6H12O6 |
11.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,足量Fe与22.4 L Cl2反应,转移的电子数为2NA | |
| B. | 0.1molO2完全反应时,转移的电子数一定为 0.4 NA | |
| C. | 用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为 0.2NA | |
| D. | 常温常压下,100 g 17% H2O2水溶液中含氧原子总数为NA |
1.Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:

回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如下图所示.由图可知,当铁的浸出率为70%时,所采用的实验条件为100℃、2h或90℃、5h.

(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O.
(3)TiO2•xH2O沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
分析40℃时TiO2•xH2O转化率最高的原因温度高反应速率加快,但温度过高过氧化氢分解、氨水易挥发,影响转化率.
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为4.
(5)若“滤液②”中c(Mg2+)=0.02mol•L-1,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5,此时是否有Mg3(PO4)2沉淀生成?c(PO43-)=$\frac{1.3×1{0}^{22}}{1×1{0}^{-5}}$=1.0×10-17mol/L,Qc[Mg3(PO4)2]=($\frac{0.02mol/L}{2}$)3×(1.0×10-17mol/L)2=1.69×10-40<Ksp=1.0×10-24,则无沉淀生成(列式计算).FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式2FePO4+Li2CO3+H2C2O4$\frac{\underline{\;高温\;}}{\;}$2LiFePO4+H2O+3CO2↑.

回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如下图所示.由图可知,当铁的浸出率为70%时,所采用的实验条件为100℃、2h或90℃、5h.

(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O.
(3)TiO2•xH2O沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
| 温度/℃ | 30 | 35 | 40 | 45 | 50 |
| TiO2•xH2O转化率/% | 92 | 95 | 97 | 93 | 88 |
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为4.
(5)若“滤液②”中c(Mg2+)=0.02mol•L-1,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5,此时是否有Mg3(PO4)2沉淀生成?c(PO43-)=$\frac{1.3×1{0}^{22}}{1×1{0}^{-5}}$=1.0×10-17mol/L,Qc[Mg3(PO4)2]=($\frac{0.02mol/L}{2}$)3×(1.0×10-17mol/L)2=1.69×10-40<Ksp=1.0×10-24,则无沉淀生成(列式计算).FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式2FePO4+Li2CO3+H2C2O4$\frac{\underline{\;高温\;}}{\;}$2LiFePO4+H2O+3CO2↑.
8.下述实验中均有红棕色气体产生,对比分析所的结论不正确的是( )
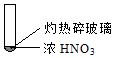 | 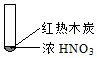 | 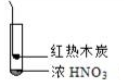 |
| ① | ② | ③ |
| A. | 由①中的红棕色气体,推断产生的气体一定是混合气体 | |
| B. | 红棕色气体不能表明②中木炭与浓硝酸产生了反应 | |
| C. | 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物 | |
| D. | ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应 |
5.常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)?Ni(CO)4(g).230℃时,该反应的平衡常数K=2×10-5.已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应.
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍.
下列判断正确的是( )
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍.
下列判断正确的是( )
| A. | 增加c(CO),平衡向正向移动,反应的平衡常数增大 | |
| B. | 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃ | |
| C. | 第二阶段,Ni(CO)4分解率较低 | |
| D. | 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO) |
 +H2O
+H2O →
→ $\stackrel{H+/H_{2}O}{→}$
$\stackrel{H+/H_{2}O}{→}$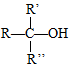

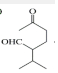 $\stackrel{O{H}^{-}}{→}$
$\stackrel{O{H}^{-}}{→}$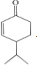 +H2O.
+H2O.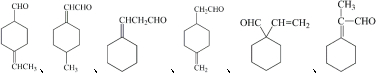
 ”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围
”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围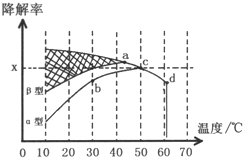 .
.