题目内容
根据表中信息,判断下列叙述中正确的是( )
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 产物 | 产物 |
| ① | Cl2 | FeBr2 | / | Cl- | |
| ② | KClO3 | 浓盐酸 | / | Cl2 |
| A、反应①中可能有一种或两种元素被氧化 |
| B、反应①中,当只有少量Cl2时,反应可表示为Cl2+Fe2+═Fe3++2Cl- |
| C、反应②中KClO3被氧化,HCl被还原 |
| D、若反应②的另一种产物是KCl,则反应过程中1molKClO3得到6mole- |
考点:氧化还原反应
专题:氧化还原反应专题
分析:反应①中,氯气可以氧化溴离子和亚铁离子,亚铁离子的还原性比溴离子强,少量氯气只能氧化亚铁离子;
反应②中,在酸性条件下氯酸根离子可以氧化氯离子生成氯气,1mol氯酸根离子得5mol电子氧化5mol氯离子,据此分析.
反应②中,在酸性条件下氯酸根离子可以氧化氯离子生成氯气,1mol氯酸根离子得5mol电子氧化5mol氯离子,据此分析.
解答:
解:A、氯气可以氧化溴离子和亚铁离子,亚铁离子的还原性比溴离子强,少量氯气只能氧化亚铁离子,故A正确;
B、离子方程式错误,应为Cl2+2Fe2+═2Fe3++2Cl-,故B错误;
C、反应②中KClO3被还原,HCl被氧化,故C错误;
D、反应②中,1mol氯酸根离子得5mol电子氧化5mol氯离子,反应过程中1molKClO3得到5mole-,故D错误;
故选A.
B、离子方程式错误,应为Cl2+2Fe2+═2Fe3++2Cl-,故B错误;
C、反应②中KClO3被还原,HCl被氧化,故C错误;
D、反应②中,1mol氯酸根离子得5mol电子氧化5mol氯离子,反应过程中1molKClO3得到5mole-,故D错误;
故选A.
点评:本题考查了氧化还原反应中的强弱规律以及归中反应中化合价变化规律,题目难度中等.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案
相关题目
某溶液中投入铝片可放出氢气,则该溶液可能存在的离子组是( )
| A、Fe2+、Cl-、NO3-、Na+、Al3+ |
| B、Mg2+、Ba2+、SO42-、Cl-、Al3+ |
| C、H+、Cl-、SO42-、K+、Al3+ |
| D、Na+、K+、SO42-、OH-、Al3+ |
如图所示装置可用于( )
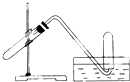

| A、用铜和稀硝酸反应制NO |
| B、用铜和浓硝酸反应制NO2 |
| C、用NH4Cl与浓NaOH溶液反应制NH3 |
| D、加热NaHCO3制CO2 |
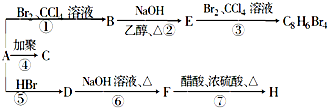
 下面给出了四种烃A、B、C、D的相关信息:
下面给出了四种烃A、B、C、D的相关信息: