题目内容
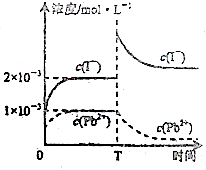 常温下,取一定量的PbI2固体配成饱和溶液,T时刻改变某一条件,离子浓度变化如图所示,下列有关说法正确的是( )
常温下,取一定量的PbI2固体配成饱和溶液,T时刻改变某一条件,离子浓度变化如图所示,下列有关说法正确的是( )| A、常温下,PbI2的Ksp为2×10-6 |
| B、温度不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,PbI2的溶解度不变,Pb2+浓度不变 |
| C、常温下Ksp[PbS]=8×10-28,向PbI2的悬浊液中加入Na2S溶液,PbI2(s)+S2-(aq)?PbS(s)+2I-(aq)反应的化学平衡常数为5×1018 |
| D、T时刻改变的条件是由于升高温度,PbI2的Ksp增大 |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:PbI2的饱和溶液中存在沉淀溶解平衡:PbI2(s)?Pb2+(aq)+2I-(aq),此反应的Ksp=c(Pb2+)×c2(I-),依据图象得知:常温下Ksp=2×10-3×(1×10-3)2此常数只与温度有关,据此解答即可.
解答:
解:A、常温下,PbI2的Ksp=1×10-3×(2×10-3)2=4×10-9,故A错误;
B、在温度不变时,向PbI2饱和溶液中加入少量硝酸铅浓溶液,Pb2+浓度增大,故B错误;
C、PbI2(s)+S2-(aq)?PbS(s)+2I-(aq)反应的化学平衡常数=
=
=
=
=5×1018,故C正确;
D、依据图象分析,T时刻I-浓度升高,Pb2+浓度降低,若改变的条件是升高温度,那么碘离子浓度与铅离子浓度应同时变大或变小,故此时不是改变的温度,故D错误,
故选C.
B、在温度不变时,向PbI2饱和溶液中加入少量硝酸铅浓溶液,Pb2+浓度增大,故B错误;
C、PbI2(s)+S2-(aq)?PbS(s)+2I-(aq)反应的化学平衡常数=
| c2(I-) |
| c(S2-) |
| ||
|
| Ksp(PbI2) |
| Ksp(PbS) |
| 4×10-9 |
| 8×10-28 |
D、依据图象分析,T时刻I-浓度升高,Pb2+浓度降低,若改变的条件是升高温度,那么碘离子浓度与铅离子浓度应同时变大或变小,故此时不是改变的温度,故D错误,
故选C.
点评:本题考查了沉淀溶解平衡的移动和计算应用,溶度积常数的分析判断与计算,题目难度中等.

练习册系列答案
相关题目
含有4个碳原子的饱和一元醇的所有醇类同分异构体中,能被氧化为醛的有( )
| A、1种 | B、2种 | C、3种 | D、4种 |
将0.1mol N2和0.3mol H2置于密闭容器中发生反应N2+3H2
2NH3 下列关于该反应的说法中正确的是( )
| 高温高压 |
| 催化剂 |
| A、增大压强,反应速率减小 |
| B、最终可生成0.2 mol NH3 |
| C、升髙温度,反应速率增大 |
| D、当v正(N2):v正(H2)=1:3时,一定达化学平衡 |
CaCO3在下列液体中溶解度最大的是( )
| A、纯水中 |
| B、0.1 mol?L-1的Na2CO3溶液中 |
| C、0.1 mol?L-1的CaCl2溶液中 |
| D、0.1 mol?L-1的CH3COOH溶液中 |
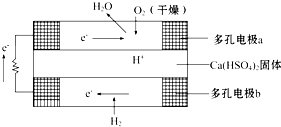 如图是某固体酸燃料电池基本结构示意图,其中以Ca(HSO4)2固体为电解质传递H+,电池总反应式为:2H2+O2═2H2O,下列有关说法不正确的是( )
如图是某固体酸燃料电池基本结构示意图,其中以Ca(HSO4)2固体为电解质传递H+,电池总反应式为:2H2+O2═2H2O,下列有关说法不正确的是( )| A、H2通过多孔电极时能增大H2的接触面积,加快反应 |
| B、a极上的电极反应式为:O2+2H2O+4e-═4OH- |
| C、每转移0.1 mol电子,消耗标准状况下的H2 1.12 L |
| D、H+由b极通过固体酸电解质传递到a极 |
仅由下列各组元素所构成的化合物,不可能属于离子化合物的是( )
| A、H,O,S |
| B、Na,H,O |
| C、K,Cl,O |
| D、H,N,S |

 CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.已知:CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写):如图请回答下列问题:
CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.已知:CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写):如图请回答下列问题: