题目内容
铁、铜及其化合物有广泛应用,请回答下列问题:
(1)①钢铁的电化腐蚀简单示意图如下图一所示,在该图虚线框内稍作修改,即可成为钢铁电化学防护的简单示意图,请在下图虚线框内做出修改,并用箭头标出电子流动方向.

②写出修改前的钢铁吸氧腐蚀石墨电极的电极反应式: .
(2)如要用图二装置电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的电极反应式是 ,②Y电极的材料是 .
(3)若用图二装置电解200mL 1mol?L-1 的AgNO3溶液(X、Y为惰性电极),当阴极质量增加2.16g时,则被电解溶液的pH为 (溶液体积变化忽略不计).
(1)①钢铁的电化腐蚀简单示意图如下图一所示,在该图虚线框内稍作修改,即可成为钢铁电化学防护的简单示意图,请在下图虚线框内做出修改,并用箭头标出电子流动方向.

②写出修改前的钢铁吸氧腐蚀石墨电极的电极反应式:
(2)如要用图二装置电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的电极反应式是
(3)若用图二装置电解200mL 1mol?L-1 的AgNO3溶液(X、Y为惰性电极),当阴极质量增加2.16g时,则被电解溶液的pH为
考点:电解原理,原电池和电解池的工作原理
专题:电化学专题
分析:(1)①由图一可知,Fe在原电池中作负极而被腐蚀,要防止铁的腐蚀,可以利用外加电源的阴极保护法,在内电路电子由正极流向负极;
②钢铁吸氧腐蚀石墨电极上氧气得到电子发生还原反应生成氢氧根离子;
(2)电解方法精炼粗铜,电解液a选用CuSO4溶液,阳极应该是粗铜与电源正极相连、阴极是纯铜与电源负极相连,则X电极是纯铜、Y电极是粗铜,阴极上铜离子放电;
(3)根据得失电子守恒规律,根据阴极上生成银的质量计算生成硝酸物质的量及其浓度,从而得出其溶液的pH.
②钢铁吸氧腐蚀石墨电极上氧气得到电子发生还原反应生成氢氧根离子;
(2)电解方法精炼粗铜,电解液a选用CuSO4溶液,阳极应该是粗铜与电源正极相连、阴极是纯铜与电源负极相连,则X电极是纯铜、Y电极是粗铜,阴极上铜离子放电;
(3)根据得失电子守恒规律,根据阴极上生成银的质量计算生成硝酸物质的量及其浓度,从而得出其溶液的pH.
解答:
解:(1)①由图一可知,Fe在原电池中作负极而被腐蚀,要防止铁的腐蚀,可以利用外加电源的阴极保护法,在内电路电子由正极流向负极,外电路电子由负极流向阴极,由阳极流向正极,装置如图所示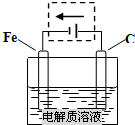 ,故答案为:
,故答案为: ;
;
②钢铁吸氧腐蚀石墨电极的电极反应式:O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
(2)电解方法精炼粗铜,阳极应该是粗铜与电源正极相连、阴极是纯铜与电源负极相连,阴极上铜离子放电,电极反应式为Cu2++2e-=Cu;
故答案为:Cu2++2e-=Cu;粗铜;
(3)电极硝酸银溶液的方程式为:4AgNO3+2 H2O
4Ag+O2↑+4HNO3,
Ag~HNO3,
108 1
2.16g n 解得n=0.02mol,所以C(H+)=C(HNO3)=
=0.1mol/L,
所以其pH=-lg[H+]=1;
故答案为:1.
 ,故答案为:
,故答案为: ;
;②钢铁吸氧腐蚀石墨电极的电极反应式:O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
(2)电解方法精炼粗铜,阳极应该是粗铜与电源正极相连、阴极是纯铜与电源负极相连,阴极上铜离子放电,电极反应式为Cu2++2e-=Cu;
故答案为:Cu2++2e-=Cu;粗铜;
(3)电极硝酸银溶液的方程式为:4AgNO3+2 H2O
| ||
Ag~HNO3,
108 1
2.16g n 解得n=0.02mol,所以C(H+)=C(HNO3)=
| 0.02mol |
| 0.1L |
所以其pH=-lg[H+]=1;
故答案为:1.
点评:本题考查了电化学知识,熟悉原电池、电解池工作原理是解题关键,题目难度中等.

练习册系列答案
相关题目
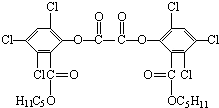 “魔棒”常被用于晚会现场气氛的渲染.其发光原理是利用H2O2氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式如图.下列说法正确的是( )
“魔棒”常被用于晚会现场气氛的渲染.其发光原理是利用H2O2氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式如图.下列说法正确的是( )| A、CPPO属于芳香烃 |
| B、CPPO属于高分子化合物 |
| C、1mol CPPO与氢氧化钠稀溶液反应(假设苯环上卤素不水解),最多消耗6mol NaOH |
| D、1mol CPPO与氢气完全反应,需要氢气10mol |
对于常温下PH=10的氨水,下列说法正确的是( )
| A、该溶液与PH=10的 Ba(OH)2溶液,溶质的物质的量浓度之比为2:1 |
| B、该溶液由水电离出来的c(H+)与PH=4的NH4Cl溶液相同 |
| C、降低温度,溶液的c(NH4+)/c(NH3?H3O)减小,PH降低 |
| D、往该溶液中加入足量的NH4Cl固体后,c(NH4+)+c(NH3?H3O)=c(Cl-) |
 一定温度下,在2L的密闭容器中,A、B、C三种气体的物质的量随时间变化的曲线如图所示,下列叙述正确的是( )
一定温度下,在2L的密闭容器中,A、B、C三种气体的物质的量随时间变化的曲线如图所示,下列叙述正确的是( )| A、反应开始到2min,用A表示的反应速率为0.1 mol?Lˉ1?minˉ1 |
| B、反应开始到2min,B的物质的量浓度增加了0.2mol/L |
| C、反应进行到2min时,该反应停止了 |
| D、反应的化学方程式为:2A(g)?2B(g)+C(g) |
全矾液流电池是一种新型电能储存和高效转化装置.某溶液中含有NO3-和Cr2O32-,现向此溶液中滴入29.00mL0.1mol/L的FeSO4溶液,恰好使VO2+→VO2+,Cr2O32-→Cr3+.再滴入2.00mL,0.020mol/LKMnO4溶液,又恰好使VO2+→VO2+,而Cr3+不变,此时MnO4→Mn2+,则原溶液中Cr的质量为( )
| A、156 mg |
| B、23 4 mg |
| C、31.2 mg |
| D、46.8mg |
已知NaHSO3溶液显酸性,溶液中存在以下平衡:HSO3-+H2O?H2SO3+OH-①HSO3-?H++SO32-②,向0.1mol?L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是( )
| A、加入少量金属Na,平衡①左移,平衡②右移,溶液中c(HSO3-)增大 | ||||||||
B、加入少量Na2SO3固体,则c(H+)+c(Na+)=c(HSO3-)+c(OH-)+
| ||||||||
C、加入少量NaOH溶液,
| ||||||||
| D、加入氨水至中性,则2c(Na+)=c(SO32-)>c(H+)=c(OH-) |
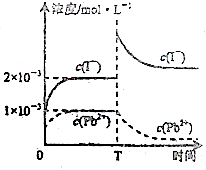 常温下,取一定量的PbI2固体配成饱和溶液,T时刻改变某一条件,离子浓度变化如图所示,下列有关说法正确的是( )
常温下,取一定量的PbI2固体配成饱和溶液,T时刻改变某一条件,离子浓度变化如图所示,下列有关说法正确的是( )| A、常温下,PbI2的Ksp为2×10-6 |
| B、温度不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,PbI2的溶解度不变,Pb2+浓度不变 |
| C、常温下Ksp[PbS]=8×10-28,向PbI2的悬浊液中加入Na2S溶液,PbI2(s)+S2-(aq)?PbS(s)+2I-(aq)反应的化学平衡常数为5×1018 |
| D、T时刻改变的条件是由于升高温度,PbI2的Ksp增大 |
将a g二氧化锰粉末加入b mol?L-1的浓盐酸c L中加热完全溶解,反应中转移电子d个,设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A、可以收集到氯气
| ||
| B、反应后溶液中的Cl-数目为2aNA/87 | ||
C、NA可表示为
| ||
| D、反应后溶液中的H+数目为(bc-2d) |
