题目内容
仅由下列各组元素所构成的化合物,不可能属于离子化合物的是( )
| A、H,O,S |
| B、Na,H,O |
| C、K,Cl,O |
| D、H,N,S |
考点:离子化合物的结构特征与性质
专题:化学键与晶体结构
分析:一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,铵根离子和酸根离子之间存在离子键,含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物,据此分析解答.
解答:
解:A.这三种元素组成亚硫酸、硫酸,这两种物质中只含共价键,属于共价化合物,故A选;
B.这三种元素形成化合物NaOH,NaOH中钠离子和氢氧根离子之间存在离子键、O-H原子之间存在共价键,属于离子化合物,故B不选;
C.这三种元素形成次氯酸钠、氯酸钠、高氯酸钠,这三种物质中钠离子和酸根离子之间存在离子键,属于离子化合物,故C不选;
D.这几种元素之间形成硫化铵、硫氢化铵,铵根离子和 酸根离子之间存在离子键,属于离子化合物,故D不选;
故选A.
B.这三种元素形成化合物NaOH,NaOH中钠离子和氢氧根离子之间存在离子键、O-H原子之间存在共价键,属于离子化合物,故B不选;
C.这三种元素形成次氯酸钠、氯酸钠、高氯酸钠,这三种物质中钠离子和酸根离子之间存在离子键,属于离子化合物,故C不选;
D.这几种元素之间形成硫化铵、硫氢化铵,铵根离子和 酸根离子之间存在离子键,属于离子化合物,故D不选;
故选A.
点评:本题考查离子化合物的判断,明确物质构成微粒及物质之间作用力即可解答,注意铵盐中都含有离子键,题目难度不大.

练习册系列答案
相关题目
对于常温下PH=10的氨水,下列说法正确的是( )
| A、该溶液与PH=10的 Ba(OH)2溶液,溶质的物质的量浓度之比为2:1 |
| B、该溶液由水电离出来的c(H+)与PH=4的NH4Cl溶液相同 |
| C、降低温度,溶液的c(NH4+)/c(NH3?H3O)减小,PH降低 |
| D、往该溶液中加入足量的NH4Cl固体后,c(NH4+)+c(NH3?H3O)=c(Cl-) |
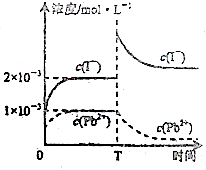 常温下,取一定量的PbI2固体配成饱和溶液,T时刻改变某一条件,离子浓度变化如图所示,下列有关说法正确的是( )
常温下,取一定量的PbI2固体配成饱和溶液,T时刻改变某一条件,离子浓度变化如图所示,下列有关说法正确的是( )| A、常温下,PbI2的Ksp为2×10-6 |
| B、温度不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,PbI2的溶解度不变,Pb2+浓度不变 |
| C、常温下Ksp[PbS]=8×10-28,向PbI2的悬浊液中加入Na2S溶液,PbI2(s)+S2-(aq)?PbS(s)+2I-(aq)反应的化学平衡常数为5×1018 |
| D、T时刻改变的条件是由于升高温度,PbI2的Ksp增大 |
下列说法正确的是( )
| A、非金属元素间形成的化合物一定是共价化合物 |
| B、分子中只有共价键的化合物一定是共价化合物 |
| C、由共价键形成的分子一定是共价化合物 |
| D、只有非金属原子间才能形成共价键 |
氢原子的3d和4s能级的能量高低是( )
| A、3d>4s |
| B、3d<4s |
| C、3d=4s |
| D、无3d、4s轨道,无所谓能量高低 |
下列实验设计及其对应的离子方程式均正确的是( )
| A、用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+ |
| B、Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑ |
| C、将氯气溶于水制备次氯酸:Cl2+H2O=2H++Cl-+ClO- |
| D、将磁性氧化铁溶于盐酸:Fe3O4+8H+═3Fe3++4H2O |
将a g二氧化锰粉末加入b mol?L-1的浓盐酸c L中加热完全溶解,反应中转移电子d个,设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A、可以收集到氯气
| ||
| B、反应后溶液中的Cl-数目为2aNA/87 | ||
C、NA可表示为
| ||
| D、反应后溶液中的H+数目为(bc-2d) |
如图X、Y、A、B、C均为短周期主族元素,其中只有一种是金属元素,则下列说法错误是( )
| X | A | ||
| Y | C | B |
| A、原子半径大小:Y>C>X>A |
| B、Y和B形成的化合物中Y和B的原子个数比为2:3 |
| C、X、C、A中最高价氧化物对应的水化物的酸性最强的是A |
| D、A、B均为非金属元素,所以两者的氢化物相遇不发生反应 |
