题目内容
CaCO3在下列液体中溶解度最大的是( )
| A、纯水中 |
| B、0.1 mol?L-1的Na2CO3溶液中 |
| C、0.1 mol?L-1的CaCl2溶液中 |
| D、0.1 mol?L-1的CH3COOH溶液中 |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:
分析:如果溶剂中含有和电离平衡正反应产物相同的离子,则发生同离子效应,抑制电离平衡,从而抑制溶解平衡.
解答:
解:CaCO3的溶解过程如下:
CaCO3(s)?Ca2++CO32-
如果溶液中有大量Ca2+ 或大量CO32-,都会使平衡左移,减小CaCO3的溶解度.这就是同离子效应.
而乙酸电离出氢离子,与碳酸根反应生成二氧化碳气体,促进平衡右移,因此CaCO3在乙酸中的溶解度比水大,
故选D.
CaCO3(s)?Ca2++CO32-
如果溶液中有大量Ca2+ 或大量CO32-,都会使平衡左移,减小CaCO3的溶解度.这就是同离子效应.
而乙酸电离出氢离子,与碳酸根反应生成二氧化碳气体,促进平衡右移,因此CaCO3在乙酸中的溶解度比水大,
故选D.
点评:本题考查同离子效应,难度不大,注意如果溶剂中含有和电离平衡正反应产物相同的离子,则发生同离子效应,抑制电离平衡,从而抑制溶解平衡

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
下列说法正确的是( )
| A、分子式为C10H12O2的有机物,①苯环上有两个取代基,②能与NaHCO3反应生成气体,满足以上2个条件的该有机物的同分异构体有15种 |
B、对苯二甲酸( )与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维( )与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维(  ) ) |
| C、分子式为C5H12O的醇,能在铜催化下被O2氧化为醛的同分异构体有5种 |
D、 分子中的所有原子有可能共平面 分子中的所有原子有可能共平面 |
对于可逆反应M+N?Q达到平衡时,下列说法中正确的是( )
| A、反应混合物各成分的百分组成不再变化 |
| B、M、N全部变成了Q |
| C、M、N、Q三种物质的浓度一定相等 |
| D、反应已经停止 |
全矾液流电池是一种新型电能储存和高效转化装置.某溶液中含有NO3-和Cr2O32-,现向此溶液中滴入29.00mL0.1mol/L的FeSO4溶液,恰好使VO2+→VO2+,Cr2O32-→Cr3+.再滴入2.00mL,0.020mol/LKMnO4溶液,又恰好使VO2+→VO2+,而Cr3+不变,此时MnO4→Mn2+,则原溶液中Cr的质量为( )
| A、156 mg |
| B、23 4 mg |
| C、31.2 mg |
| D、46.8mg |
化学已渗透到人类生活的方方面面,下列说法正确的是( )
| A、离子交换膜在工业生产中广泛应用,如氯碱工业使用了阴离子交换膜 |
| B、白酒标签上注有“酒精度52%Vol”字样,它表示100g该白酒中含有52g酒精 |
| C、开发氢能、太阳能、风能、生物质能等是实现“低碳生活”的有效途径 |
| D、泡沫灭火器是最常见的灭火器之一,其内筒为塑料桶,盛有碳酸氢钠溶液;外筒为铁桶,外筒和内筒之间装有硫酸铝溶液 |
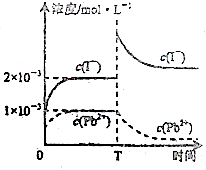 常温下,取一定量的PbI2固体配成饱和溶液,T时刻改变某一条件,离子浓度变化如图所示,下列有关说法正确的是( )
常温下,取一定量的PbI2固体配成饱和溶液,T时刻改变某一条件,离子浓度变化如图所示,下列有关说法正确的是( )| A、常温下,PbI2的Ksp为2×10-6 |
| B、温度不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,PbI2的溶解度不变,Pb2+浓度不变 |
| C、常温下Ksp[PbS]=8×10-28,向PbI2的悬浊液中加入Na2S溶液,PbI2(s)+S2-(aq)?PbS(s)+2I-(aq)反应的化学平衡常数为5×1018 |
| D、T时刻改变的条件是由于升高温度,PbI2的Ksp增大 |
通常把原子总数和价电子总数相同的分子或离子称为等电子体.人们发现等电子体的空间结构相同,则下列有关说法中正确的是( )
| A、CH4和NH4+是等电子体,键角均为60° |
| B、B3N3H6和苯是等电子体,1molB3N3H6和苯均有6mol非极性键 |
| C、CH4和P4均为正四面体结构,故二者是等电子体 |
| D、BF3和CO32-是等电子体,均为平面三角形结构 |
下列说法正确的是( )
| A、非金属元素间形成的化合物一定是共价化合物 |
| B、分子中只有共价键的化合物一定是共价化合物 |
| C、由共价键形成的分子一定是共价化合物 |
| D、只有非金属原子间才能形成共价键 |
设NA代表阿伏加德罗常数的数值,下列说法正确的是( )
| A、10 mL 20 mol?L-1浓硫酸与足量锌反应,转移电子数为0.2NA |
| B、0.1 mol24Mg18O晶体中所含中子总数为2.0 NA |
| C、在标准状况下,2.8g N2和2.24L CO所含电子数均为1.4NA |
| D、1 L 1 mol?L-1的NaClO溶液中含有ClO-的数目为NA |