题目内容
13.通常情况下,NCl3是一种油状液体,其分子空间构型与氨分子相似,下列对NCl3的有关叙述正确的是( )| A. | NCl3和SiO32-的中心原子的杂化方式相同,都是sp3杂化 | |
| B. | 分子构型为平面三角形 | |
| C. | NCl3比NBr3易挥发 | |
| D. | NC13是极性键构成的非极性分子 |
分析 A.根据杂化轨道数判断杂化类型,杂化轨道数=δ键数+孤对电子对数,据此判断杂化类型;
B.分子空间构型与氨分子相似;
C.根据分子晶体中物质的熔沸点与相对分子质量有关,相对分子质量越大,其熔沸点越高,物质的熔沸点越低越容易挥发;
D.分子空间构型对称,正负电荷中心重叠的为非极性分子.
解答 解:A.NCl3中N的价层电子对数=3+$\frac{5-3×1}{2}$=4,为sp3杂化,SiO32-中Si的价层电子对数=3+$\frac{4+2-3×2}{2}$=3,为sp2杂化,故A错误;
B.NCl3的空间构型与氨分子相似,为三角锥形,故B错误;
C.分子晶体,相对分子质量越大,其熔沸点越高,所以NBr3比NCl3的熔沸点高,NCl3比NBr3易挥发,故C正确;
D.NCl3的分子空间构型与氨分子相似,都是三角锥型结构,氨分子是极性分子,所以NCl3分子也是极性分子,故D错误.
故选C.
点评 本题以信息的形式考查NCl3分子空间结构、分子极性、熔沸点等知识,明确题中信息并结合氨气的空间构型分析即可解答,题目难度不大,注意把握杂化类型的判断方法.

练习册系列答案
相关题目
4.下列关于石油的成分与加工的说法错误的是( )
| A. | 天然气的化学组成主要是烃类气体,以甲烷为主 | |
| B. | 石油中含有1-50个碳原子的烷烃和环烷烃 | |
| C. | 石油的催化重整不可能获得芳香烃 | |
| D. | 石油的催化裂解是工业生产乙烯的重要环节 |
1.原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1.a-的电子层结构与氦相同,b和c的次外层有8个电子,c-和d+的电子层结构相同.下列叙述错误的是( )
| A. | 元素的非金属性次序为c>b>a | |
| B. | a和其他3种元素均能形成共价化合物 | |
| C. | 元素b、c的气态氢化物的稳定性:b<c | |
| D. | 元素b、c的最高价氧化物对应的水化物的酸性:b>c |
8.下列化学式只能表示一种物质的是( )
| A. | C3H6 | B. | C2H6O | C. | C6H6 | D. | CH2Cl2 |
5.下列关于价电子构型为4s24p4的基态原子描述正确的是( )
| A. | 它的元素名称为锡 | B. | 它的核外电子排布式为[Ar]4s24p4 | ||
| C. | 它的第一电离能小于As | D. | 其外围电子排布图为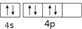 |
2.下列各组有机物的鉴别(括号内为鉴别试剂)不合理的是( )
| A. | 苯、甲苯、溴乙烷(酸性高锰酸钾溶液) | B. | 乙醇、乙醛、乙酸(新制Cu(OH)2) | ||
| C. | 苯、乙醇、四氯化碳(溴水) | D. | 苯、己烷、苯酚溶液(浓溴水) |
3.温度为T 时,将0.40mol A气体充入2.0L固定容积的密闭容器中,发生反应A(g)═2B(g);△H>0,经过一段时间后达到平衡.反应过程中测得的部分数据见下表:下列说法正确的是( )
| 时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
| n(A)/mol | 0.40 | - | 0.20 | - | - | 0.10 |
| n(B)/mol | 0.00 | 0.24 | - | 0.52 | 0.60 | 0.60 |
| A. | 0~40 s的平均反应速率v(B)=0.01 mol•L-1•s-1 | |
| B. | 80 s时容器中混合气体的密度小于40 s时混合气体的密度 | |
| C. | 其他条件不变,加入合适的催化剂,0~80 s时间段内v(A)>0.001 875 mol•L-1•s-1 | |
| D. | 反应达到最大限度后,增加A的浓度,B的生成速率不变 |
 .
.