题目内容
2.某实验小组设计如下装置探究氨气的性质: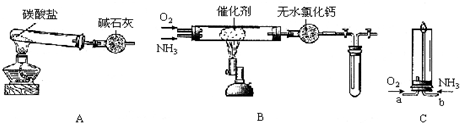
(1)制备氨气:用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是(NH4)2CO3或NH4HCO3;碱石灰的作用是吸收水和二氧化碳.
(2)氨的催化氧化:将产生的氨气与过量的氧气通到装置B中,用酒精喷灯加热催化剂至红热,熄灭酒精喷灯,反应仍能继续进行,说明反应是放(填“吸”或“放”)热反应;化学方程式为4NH3+5O2 $\frac{\underline{催化剂}}{△}$4NO+6H2O.当试管内气体变为红棕色后,停止反应,立即关闭B中两个活塞,并将试管浸入冰水中,试管内气体颜色变浅(填“深”或“浅”),原因是2NO2?N2O4 △H<0,降温平衡向正反应方向移动,部分红棕色的NO2转化为无色N2O4.
(3)点燃氨气:已知“氨气可在纯氧中安静地燃烧,变成氮气”.将氧气和氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气:①两气体通入的先后顺序是先通O2,后通NH3;②氨气燃烧的化学方程式是4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O.
分析 (1)碳酸盐加热分解能产生NH3,只有(NH4)2CO3或NH4HCO3,碱石灰可以吸收酸性气体,并用于干燥氨气;
(2)氨气在催化剂作用下反应生成一氧化氮和水,为放热反应,一氧化氮不稳定,容易与空气中的氧气反应生成红棕色的二氧化氮;由于2NO2(g)?N2O4(g);△H<0,正反应为放热反应,当温度降低时,平衡向正反应方向移动,依次进行判断;
(3)若先通入NH3,NH3在空气中不能点燃,可在纯氧中安静燃烧.
解答 解:(1)碳酸盐加热分解能产生NH3,只有(NH4)2CO3或NH4HCO3,碱石灰可以吸收酸性气体,并用于干燥氨气,所以碱石灰的作用:吸收水和二氧化碳;
故答案为:(NH4)2CO3或NH4HCO3;吸收水和二氧化碳;
(2)将产生的氨气与过量的氧气通到装置B中,用酒精喷灯加热催化剂至红热,熄灭酒精喷灯,反应仍能继续进行,说明反应是放热反应,反应的方程式为4NH3+5O2 $\frac{\underline{催化剂}}{△}$4NO+6H2O,将试管浸入冰水中,由于2NO2(g)?N2O4(g)△H<0,正反应为放热反应,当温度降低时,平衡向正反应方向移动,部分红棕色的NO2转化为无色N2O4,故颜色变浅.
故答案为:放;4NH3+5O2 $\frac{\underline{催化剂}}{△}$4NO+6H2O;浅;2NO2?N2O4 △H<0,降温平衡向正反应方向移动,部分红棕色的NO2转化为无色N2O4;
(3)由于装置C上端开口,要点燃NH3,须先通入O2,后通入NH3,因为若先通入NH3,NH3在空气中不能点燃,NH3逸出会造成污染,反应的化学方程式为4NH3+3O2 $\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O,
故答案为:先通O2,后通NH3;4NH3+3O2 $\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O.
点评 本题考查无机物的性质实验,为信息给予题,为高考常见题型,题目侧重考查氨气的有关性质,做题时注意题中“氨气可在纯氧中安静燃烧…”这一重要信心,结合氨气的性质解答问题,难度中等.

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案| A. | SO2具有氧化性,可用于漂白纸浆 | B. | NH4HCO3含有氮元素,可用作氮肥 | ||
| C. | Fe2(SO4)3易溶于水,可用作净水剂 | D. | Al2O3硬度大,可用作耐高温材料 |
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |
(2)C的氢化物的电子式为
 .
.(3)B的最高价氧化物的水化物与C的最高价氧化物的水化物反应的离子方程式为:Al(OH)3+3H+=Al3+3H2O;
(4)上述五种元素的最高价氧化物对应水化物的酸性最强的是HClO4(填化学式);
(5)C、E形成的化合物为SO2、SO3(填化学式)
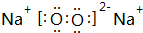
(6)用电子式表示AD形成化合物的过程:
 .
. | A. | 油脂分子中都含有碳碳双键 | B. | 葡萄糖分子中含有羟基和醛基 | ||
| C. | 水分子中含有羟基 | D. | 乙酸乙酯分子中含有羧基 |
 (用电子式表示)
(用电子式表示)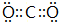 (用电子式表示)
(用电子式表示)