题目内容
10.设NA为阿伏加德罗常数值,下列说法正确的是( )| A. | 标准状况下,2.24 L CC14所含的原子数为0.5 NA | |
| B. | 0.1 mol FeCl3水解生成的Fe(OH)3胶粒数为0.1 NA | |
| C. | 将lmol Cl2通人水中,HC1O、Cl-、C1O-粒子数之和为2 NA | |
| D. | 11.2 g 铁粉与足量稀硝酸反应失去电子数一定为0.6 NA |
分析 A、标况下四氯化碳为液体;
B、一个氢氧化铁胶粒是多个氢氧化铁的聚集体;
C、氯气和水的反应为可逆反应;
D、求出铁粉的物质的量,然后根据铁和足量的稀硝酸反应后变为+3价来分析.
解答 解:A、标况下四氯化碳为液体,故不能根据气体摩尔体积来计算其物质的量,故A错误;
B、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故所得胶粒的个数小于0.1NA个,故B错误;
C、氯气和水的反应为可逆反应,故不能反应彻底,溶液中有未反应的氯气分子,故HC1O、Cl-、C1O-粒子数之和小于2 NA,故C错误;
D、11.2g铁粉的物质的量为0.2mol,而铁和足量的稀硝酸反应后变为+3价,故0.2mol铁反应失去0.6NA个电子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
相关题目
20.为了检验某氯化烃中的氯元素,现进行如下操作.其中合理的是( )
| A. | 取氯代烃少许,加入AgNO3溶液 | |
| B. | 取氯代烃少许与NaOH水溶液共热,然后加入AgNO3溶液 | |
| C. | 取氯代烃少许与NaOH水溶液共热后,加入稀硝酸酸化,再加入AgNO3 | |
| D. | 取氯代烃少许与NaOH乙醇溶液共热后,加入稀硝酸酸化,再加入AgNO3溶液 |
1.设NA为阿伏加德罗常数的数值.下列有关叙述正确的是( )
| A. | 1mol苯完全转化为环己烷,参与反应的碳碳双键数为3NA | |
| B. | 常温下,2.7 gAl与足量浓度为18 mo1/L的浓硫酸反应时,转移的电子数为0.3NA | |
| C. | 1L 2mol•L-1CH3COONH4 溶液中含有的NH4+数目为2NA | |
| D. | 标准状况下,22.4L的CCl4含有的CCl4分子数大于NA |
18.短周期主族元素X、Y、Z和W的原子序数依次递增,且在同一周期,四种元素所在族的族序数之和为18,X和Z元素原子的原子序数比3:4,X的最高正价是W的最低负价的绝对值的2倍.下列说法正确的是( )
| A. | X的氧化物的熔点比Y的氧化物的熔点低 | |
| B. | X的氧化物和Z的最高价氧化物化合的产物中有共价键和离子键 | |
| C. | 简单离子半径:W>Z>Y>X | |
| D. | Z的氢化物比W的氢化物更稳定 |
5.药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:
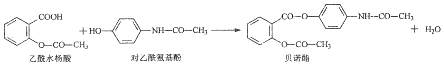
下列有关叙述不正确的是( )

下列有关叙述不正确的是( )
| A. | 贝诺酯分子中有2种含氧官能团 | |
| B. | 可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚 | |
| C. | lmol乙酰水杨酸最多消耗3molNaOH | |
| D. | 贝诺酯与足量NaOH溶液共热,最终生成乙酰水杨酸钠和对乙酰氮基酚钠 |
15.下列化学用语正确的是( )
| A. | Cl-离子的结构示意图: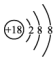 | |
| B. | 甲烷的球棍模型: | |
| C. | H2O2的电子式: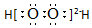 | |
| D. | 碳酸氢钠的电离方程式:NaHCO3═Na++HCO3- |
2.NH3是一种重要的化工原料,可以制备一系列物质(如图).下列有关表述正确的是( )

| A. | NH4Cl和NaHCO3都是常用的化肥 | |
| B. | NH4Cl和HNO3受热时都易分解 | |
| C. | NH3和NO2在一定条件下可发生氧化还原反应 | |
| D. | 图中所涉及的盐类物质均为含氧酸盐 |
13.下列物质不属于苯的同系物的是( )
| A. |  | B. |  | C. |  | D. |  |
14.下列实验操作对应现象的预测或描述正确的是( )
| 选项 | 实验操作 | 现象的预测或描述 |
| A | 向AlCl3溶液中逐滴加入稀氨水至过量 | 先有白色沉淀生成,后沉淀溶解消失 |
| B | 用坩埚钳夹住一小块用砂纸仔细打磨过的镁条,在酒精灯上点燃后伸入盛满CO2的集气瓶中 | 燃着的镁条熄天 |
| C | 把SO2气体通入紫色石蕊溶液中 | 溶液先变红后褪色 |
| D | 向NH4Cl溶液中加入NaOH溶液,微热,用湿润的红色石蕊试纸检验逸出的气体 | 红色石蕊试纸变蓝 |
| A. | A | B. | B | C. | C | D. | D |