题目内容
14.下列实验操作对应现象的预测或描述正确的是( )| 选项 | 实验操作 | 现象的预测或描述 |
| A | 向AlCl3溶液中逐滴加入稀氨水至过量 | 先有白色沉淀生成,后沉淀溶解消失 |
| B | 用坩埚钳夹住一小块用砂纸仔细打磨过的镁条,在酒精灯上点燃后伸入盛满CO2的集气瓶中 | 燃着的镁条熄天 |
| C | 把SO2气体通入紫色石蕊溶液中 | 溶液先变红后褪色 |
| D | 向NH4Cl溶液中加入NaOH溶液,微热,用湿润的红色石蕊试纸检验逸出的气体 | 红色石蕊试纸变蓝 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氢氧化铝不溶于氨水,沉淀不会消失;
B.Mg能够在二氧化碳中燃烧;
C.二氧化硫不能使酸碱指示剂褪色;
D.氨气能够使湿润的红色石蕊试纸变蓝.
解答 解:A.向AlCl3溶液中逐滴加入稀氨水至过量,最终得到的是氢氧化铝沉淀,沉淀不会溶解,故A错误;
B.Mg能够与二氧化碳反应生成氧化镁和C,则燃着的Mg条伸入盛满CO2的集气瓶中不会熄灭,故B错误;
C.把SO2气体通入紫色石蕊溶液中,溶液变红但不会褪色,故C错误;
D.向NH4Cl溶液中加入NaOH溶液,微热,二者反应生成氨气,用湿润的红色石蕊试纸检验逸出的气体,氨气能够使红色石蕊试纸变蓝,故D正确;
故选D.
点评 本题考查化学实验方案的评价,题目难度中等,涉及金属Mg、Al及其化合物性质、二氧化硫性质、离子检验等知识,明确常见元素及其化合物性质为解答关键,试题培养了学生的化学实验能力.

练习册系列答案
相关题目
10.设NA为阿伏加德罗常数值,下列说法正确的是( )
| A. | 标准状况下,2.24 L CC14所含的原子数为0.5 NA | |
| B. | 0.1 mol FeCl3水解生成的Fe(OH)3胶粒数为0.1 NA | |
| C. | 将lmol Cl2通人水中,HC1O、Cl-、C1O-粒子数之和为2 NA | |
| D. | 11.2 g 铁粉与足量稀硝酸反应失去电子数一定为0.6 NA |
9.下列有关说法不正确的是( )
| A. | “凡造竹纸…用上好石灰化汁涂浆”,造纸利用了石灰的碱性 | |
| B. | “曾青(硫酸铜)涂铁,铁赤色如铜”,过程中发生了罝换反应 | |
| C. | 人民币防伪荧光油墨由颜料与树脂连接料等制成,其中树脂属于有机高分子材料 | |
| D. | 含钙镁离子的硬水均可通过煮沸的方法使之软化 |
19.下列实验中,对应的现象以及结论均正确的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 向淀粉水解后的溶液中滴加银氨溶液 | 未见银镜产生 | 淀粉没有水解 |
| B | 混合分别装有Cl2和NH3的集气瓶中的气体 | 产生大量白烟 | NH3显还原性和碱性 |
| C | 向1.0mol•L-1的NaHA溶液中滴加2滴甲基橙 | 溶液呈黄色 | NaHA溶液显碱性 |
| D | 相同的锌片分别与同温同体积,且c(H+)=1mol•L-1的盐酸、硫酸反应 | 锌与盐酸反应产生气泡较快 | 一定是Cl-对该反应起到促进作用 |
| A. | A | B. | B | C. | C | D. | D |
6.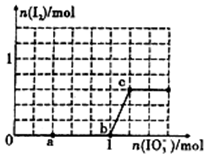 已知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加人KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法不正确的是( )
已知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加人KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法不正确的是( )
 已知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加人KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法不正确的是( )
已知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加人KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法不正确的是( )| A. | 0-a段发生反应:3 HSO3-+IO3-═3SO42-+I-+3H+ | |
| B. | a~b段共消耗NaHSO3的物质的量为1.8mol | |
| C. | b~c段反应:氧化产物为I2 | |
| D. | 当溶液中I-与I2的物质的量之比为5:1时,加入的KIO3为1.lmol |
5. 如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质推压到甲针筒内,进行表中所列的4个不同实验(气体体积在同温同压下测定).下列说法正确的是( )
如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质推压到甲针筒内,进行表中所列的4个不同实验(气体体积在同温同压下测定).下列说法正确的是( )
 如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质推压到甲针筒内,进行表中所列的4个不同实验(气体体积在同温同压下测定).下列说法正确的是( )
如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质推压到甲针筒内,进行表中所列的4个不同实验(气体体积在同温同压下测定).下列说法正确的是( )| 实验序号 | 甲针筒内物质 | 乙针筒内物质 |
| 1 | 10mL HCl | 10mL NH3 |
| 2 | 30mL NO2 | 10mL H2O(液) |
| 3 | 20mL HBr | 10mL Cl2 |
| 4 | 10mL CCl4 | 10mL NH3 |
| A. | 上述4个实验均发生了氧化还原反应 | |
| B. | 实验2,甲针筒内最终的无色气体是NO | |
| C. | 实验3,甲针筒内充满黄绿色气体 | |
| D. | 实验4,甲针筒内活塞将向右移动 |