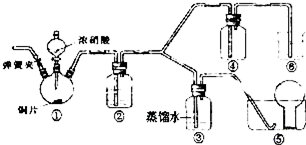
题目内容
2.下列各组排列顺序不正确的是( )| A. | 原子半径:钠>硫>氯 | B. | 氧化性:Na+>K+ | ||
| C. | 最高正化合价:氯>硫>磷 | D. | 酸性:HF>HCl>HBr |
分析 A、同周期元素从左到右元素的原子半径逐渐减小;
B、碱金属单质随核电荷数递增,还原性逐渐增强,对应离子的氧化性逐渐减弱;
C、可根据原子最外层电子数判断最高正价;
D、卤族氢化物的水溶液中,其酸性随着原子序数增大而增强;
解答 解:A、同周期元素从左到右元素的原子半径逐渐减小,则有原子半径:钠>硫>氯,故A正确;
B、碱金属单质随核电荷数递增,还原性逐渐增强,对应离子的氧化性逐渐减弱,氧化性Na+>K+,故B正确;
C、Cl、S、P的最外层电子数分别为7、6、5,最高正化合价分别为+7、+6、+5,正则最高正价:氯>硫>磷,故C正确;
D、卤族氢化物的水溶液中,其酸性随着原子序数增大而增强,所以酸性:HF<HBr<HCl<HI,故D错误;
故选D.
点评 本题考查同一主族元素及其化合物性质,以碱金属族、卤族为代表的同一主族元素性质具有相似性和递变性,熟记其递变规律,灵活运用,题目难度不大.

练习册系列答案
相关题目
13.室温下,用0.1g金属粉末与10mL酸溶液反应,在反应开始阶段,产生H2的速率最快的是( )
| 金属(粉末状) | 酸的浓度 | |
| A | Mg | 6 mol/L硝酸 |
| B | Zn | 3 mol/L硫酸 |
| C | Fe | 6 mol/L盐酸 |
| D | Cu | 6 mol/L硫酸 |
| A. | A | B. | B | C. | C | D. | D |
10.下列有关化学用语表示正确的是( )
| A. | 硫原子的结构示意图: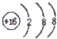 | B. | Na2S的电子式:Na+: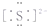 | ||
| C. | HCl的结构式:H-Cl | D. | CH4分子的球模型: |
17.某原电池装置示意图如图所示.下列关于该原电池的说法正确的是( )


| A. | 锌片发生还原反应 | |
| B. | 该装置将电能转化为化学能 | |
| C. | 电子由铁电极经导线流向锌电极 | |
| D. | 如果将锌片换成铜片,电路中的电流方向将会改变 |
14.C5H11(戊醇)发生下列反应时,所得有机产物结构种数最少(不考虑立体异构)的是( )
| A. | 与浓硫酸共热发生消去反应 | B. | 与浓氢溴酸发生卤代反应 | ||
| C. | 与氧气、铜发生催化氧化反应 | D. | 与草酸发生酯化反应 |
12.下列关于电解质溶液的叙述正确的是( )
| A. | 常温下,在pH=7的醋酸钠和醋酸混合溶液中:c(CH3COO-)>c(Na+) | |
| B. | 1 mol•L-1的硫化钠溶液中,c(H+)+c(Na+)=c(OH-)+c(HS-)+c(S2-) | |
| C. | 稀释醋酸溶液,溶液中所有离子的浓度均降低 | |
| D. | pH=5的氯化钠和稀硝酸的混合溶液中,c(Na+)=c(Cl-) |


 .
.