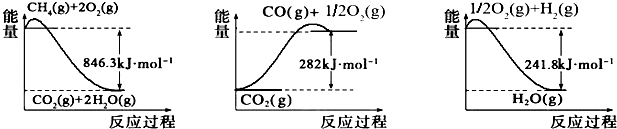
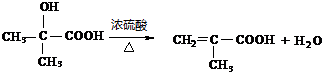题目内容
10.在一大试管中装入10mL NO,倒立于水槽中,然后慢慢地通入6mL O2,下面有关实验最终状态的描述中,正确的是( )| A. | 试管内气体呈红棕色 | B. | 试管内气体无色,是NO | ||
| C. | 试管内气体无色,是O2 | D. | 试管内液面下降 |
分析 试管内装有NO,然后缓慢地通入O2,当一氧化氮和氧气恰好反应生成硝酸发生的反应为:4NO+3O2+2H2O=4HNO3,结合一氧化氮和氧气按照4:3全部溶于水进行定性分析,在一大试管中装入10mL NO,倒立于水槽中,然后慢慢地通入6mL O2,反应后剩余一氧化氮.
解答 解:A、上述分析可知,剩余气体为NO,气体不可能呈红棕色,故A错误;
B、慢慢地通入6mL O2,依据化学方程式计算消耗NO气体8ml,若最终有气体剩余,气体是NO,故B正确;
C、4NO+3O2+2H2O=4HNO3,所以试管内溶液为稀的硝酸溶液,大试管中装入10mL NO,倒立于水槽中,然后慢慢地通入6mL O2,剩余气体是一氧化氮,故C错误;
D、一氧化氮、氧气和水反应生成硝酸,随气体的量减少,试管内压强变小,导致液面在不停上升,故D错误;
故选B.
点评 本题考查了一氧化氮和氧气混合溶于水反应的定性关系分析,掌握物质性质和相关化学反应是解题关键,题目难度中等.

练习册系列答案
相关题目
20.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA | |
| B. | 一定温度下,1 L 0.50 mol•L-1 NH4NO3溶液中含氮原子个数为NA | |
| C. | 过氧化氢分解制得1.12 L O2,转移电子数目为 0.2 NA | |
| D. | 235g核素${\;}_{92}^{235}$U发生裂变反应:${\;}_{92}^{235}$U+${\;}_{0}^{1}$n$\stackrel{裂变}{→}$${\;}_{38}^{90}$Sr+${\;}_{54}^{136}$Xe+10${\;}_{0}^{1}$n,净产生的中子(${\;}_{0}^{1}$n)数为10NA |
1.某合作学习小组讨论辨析以下说法:
①铝热剂和漂白粉都是混合物;
②金属氧化物都是碱性氧化物;
③冰和干冰既是纯净物又是化合物;
④不锈钢和目前流通的硬币都是合金;
⑤盐酸和食醋既是化合物又是酸;
⑥纯碱和熟石灰都是碱;
⑦豆浆和雾都是胶体.
上述说法正确的是( )
①铝热剂和漂白粉都是混合物;
②金属氧化物都是碱性氧化物;
③冰和干冰既是纯净物又是化合物;
④不锈钢和目前流通的硬币都是合金;
⑤盐酸和食醋既是化合物又是酸;
⑥纯碱和熟石灰都是碱;
⑦豆浆和雾都是胶体.
上述说法正确的是( )
| A. | ①②③④ | B. | ①②⑤⑥ | C. | ③⑤⑥⑦ | D. | ①③④⑦ |
18.现有常温下的四份溶液:①0.01mol•L-1 CH3COOH溶液;②0.01mol•L-1盐酸;③pH=12的氨水;④pH=12的NaOH溶液.下列说法正确的是( )
| A. | ①中水的电离程度最小,③中水的电离程度最大 | |
| B. | 等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:④最大 | |
| C. | 将四份溶液稀释相同倍数后,溶液的pH:③>④,②>① | |
| D. | 将②、③混合,若pH=7,则消耗溶液的体积:②<③ |
5.下列反应的离子方程式正确的是( )
| A. | 铜片加入FeCl3溶液中:Cu+2Fe3+═2Fe2++Cu2+ | |
| B. | 盐酸中加入Ca CO3:CO32-+2H+═H2O+CO2↑ | |
| C. | Na2O2与H2O反应:Na2O2+H2O═2Na++2OH-+O2↑ | |
| D. | 向Fe(OH)2中加入足量稀硝酸:Fe(OH)2+2H+═Fe2++2H2O |
2.向2.0L恒容密闭容器中充入1.0mol PCl5,在温度为T时发生如下反应PCl5(g)?PCl3(g)+Cl2(g)△H=+124kJ•mol-1.反应过程中测定的部分数据见下表:
回答下列问题:
(1)反应在前50s的平均速率v(PCl5)=0.0016mol/(L•s),该反应的△S>0(填“<”、“>”或“=”).
(2)温度为T时,该反应的化学平衡常数=0.025.
(3)上述反应到达平衡状态时,PCl3的体积分数为16.7%.
要提高平衡时PCl3的体积分数,可采取的措施有CD.
A.温度不变,压缩容器体积增大压强 B.使用高效催化剂
C.温度和体积不变,减小PCl5的起始量 D.体积不变,提高反应温度
(4)在温度为T时,若起始时向容器中充入0.5mol PCl5和a mol Cl2平衡时PCl5的转化率仍为20%,则a=0.1.
(5)在热水中,五氯化磷完全水解,生成磷酸(H3PO4),该反应的化学方程式是PCl5+4H2O=H3PO4+5HCl.
| 时间t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
(1)反应在前50s的平均速率v(PCl5)=0.0016mol/(L•s),该反应的△S>0(填“<”、“>”或“=”).
(2)温度为T时,该反应的化学平衡常数=0.025.
(3)上述反应到达平衡状态时,PCl3的体积分数为16.7%.
要提高平衡时PCl3的体积分数,可采取的措施有CD.
A.温度不变,压缩容器体积增大压强 B.使用高效催化剂
C.温度和体积不变,减小PCl5的起始量 D.体积不变,提高反应温度
(4)在温度为T时,若起始时向容器中充入0.5mol PCl5和a mol Cl2平衡时PCl5的转化率仍为20%,则a=0.1.
(5)在热水中,五氯化磷完全水解,生成磷酸(H3PO4),该反应的化学方程式是PCl5+4H2O=H3PO4+5HCl.


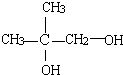 .
.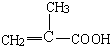 .
.