题目内容
19.有机玻璃是甲基丙烯酸甲酯的聚合物,已知烯烃可被酸性高锰酸钾溶液氧化成二元醇,如
现以2-甲基丙烯为原料,通过下列合成路线制取有机玻璃

(1)B的结构简式为:
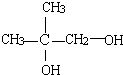 .
.C中含有的官能团名称分别是羟基、羧基.D的结构简式为:
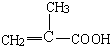 .
.(2)写出C→D的化学方程式:
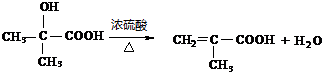
(3)写出反应类型:Y反应属于酯化反应(或取代反应),Z反应属于加聚反应(或聚合反应).
分析 由题给信息可知(CH3)2C=CH2在酸性高锰酸钾溶液中氧化生成B为 ,-CH2OH可进一步被氧化为-COOH,在浓硫酸作用下醇发生消去反应生成D为
,-CH2OH可进一步被氧化为-COOH,在浓硫酸作用下醇发生消去反应生成D为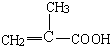 ,D和甲醇在浓硫酸作用下发生酯化反应生成E为
,D和甲醇在浓硫酸作用下发生酯化反应生成E为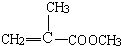 ,E中含有C=C,可发生加聚反应生成有机玻璃
,E中含有C=C,可发生加聚反应生成有机玻璃 ,据此答题.
,据此答题.
解答 解:由题给信息可知(CH3)2C=CH2在酸性高锰酸钾溶液中氧化生成B为 ,-CH2OH可进一步被氧化为-COOH,在浓硫酸作用下醇发生消去反应生成D为
,-CH2OH可进一步被氧化为-COOH,在浓硫酸作用下醇发生消去反应生成D为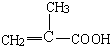 ,D和甲醇在浓硫酸作用下发生酯化反应生成E为
,D和甲醇在浓硫酸作用下发生酯化反应生成E为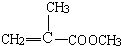 ,E中含有C=C,可发生加聚反应生成有机玻璃
,E中含有C=C,可发生加聚反应生成有机玻璃 ,
,
(1)B为 ,根据C的结构简式可知,C中含有的官能团名称分别是羟基和羧基,D为
,根据C的结构简式可知,C中含有的官能团名称分别是羟基和羧基,D为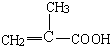 ,
,
故答案为: ;羟基;羧基;
;羟基;羧基;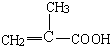 ;
;
(2)C→D的化学方程式为: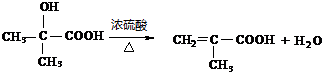 ,
,
故答案为: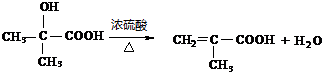 ;
;
(3)根据上面的分析可知,Y反应属于 酯化反应(或取代反应),Z反应属于加聚反应(或聚合反应),
故答案为:酯化反应(或取代反应);加聚反应(或聚合反应).
点评 本题考查有机物的推断,题目难度不大,解答本题的关键是把握相关有机物的性质,结合题给信息判断可能的反应,可推断出有机物.

练习册系列答案
相关题目
10.在一大试管中装入10mL NO,倒立于水槽中,然后慢慢地通入6mL O2,下面有关实验最终状态的描述中,正确的是( )
| A. | 试管内气体呈红棕色 | B. | 试管内气体无色,是NO | ||
| C. | 试管内气体无色,是O2 | D. | 试管内液面下降 |
7.用酸性氢氧燃料电池电解硫酸钠饱和溶液的装置如图所示 (a、b为铜电极).下列说法中不正确的是( )
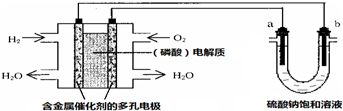

| A. | 电池工作时,正极反应式为:O2+4H++4e-═2H2O | |
| B. | 电解时,当阴极逸出amol气体,同时有W克Na2SO4﹒10H2O 析出,保持温度不变,剩余溶液中的硫酸钠的质量分数是$\frac{71W}{161(W+36a)}$×100% | |
| C. | 电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 | |
| D. | 忽略能量损耗,当电池中消耗0.01g O2时,b 极周围会产生0.02g H2 |
14.2015年2月28日,前央视记者柴静推出了她自费拍摄的雾霾深度调查《穹顶之下》,纪录片中阐述了“雾霾是什么,它从哪里来,我们该怎么办”三个问题,下面有关叙述正确的是( )
| A. | PM2.5表示每立方米空气中直径小于或等于2.5微米的颗粒物的含量,PM2.5值越高,大气污染越严重.因此由PM2.5引起的雾霾一定属于气溶胶 | |
| B. | 纪录片中详细阐述了煤的大量燃烧是产生雾霾的主要原因,如果使用前对煤进行脱硫处理,可减少二氧化硫的排放;石膏法脱硫工艺是一种常用的脱硫技术 | |
| C. | 汽车尾气中的氮氧化物和碳氢化合物在大气环境中受强烈的太阳紫外线照射后产生一种新的二次污染物--光化学烟雾也会引起雾霾,汽车尾气中含有氮氧化物,原因是汽油燃烧不充分 | |
| D. | 多植树造林,使用“乙醇汽油”,改燃煤为燃气,外出时使用PM2.5的口罩等都是治理“雾霾”等灾害性天气的有效措施 |
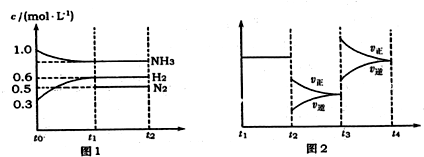
4.一定温度下可逆反应:A(s)+2B(g)?2C(g)+D(g);△H>0.现将1molA和2molB加入 甲容器中,将4molC和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动).下列说法正确的是( )


| A. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| B. | 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增加 | |
| C. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 | |
| D. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
11.下列说法正确的是( )
| A. | 按系统命名法,化合物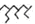 的名称为2,4 一二乙基-6-丙基辛烷 的名称为2,4 一二乙基-6-丙基辛烷 | |
| B. | 月桂烯 (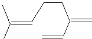 )所有碳原子一定在同一平面上 )所有碳原子一定在同一平面上 | |
| C. | 向浓醋酸溶液中加入少量碳酸钠溶液,将产生气体通入苯酚钠溶液,苯酚钠溶液中出现白色浑浊,说明酸性:醋酸>碳酸>苯酚 | |
| D. | 在盛有试粉溶液的试管中加入70%的硫酸边搅拌边加热5分钟,冷却至室温,再加入氢氧化钠中和至碱性.加入银氨溶液水浴加热,产生银镜.说明淀粉水解能产生还原性糖 |
8.下列说法正确的是( )
| A. | 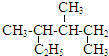 的系统命名是3,4-二甲基己烷 的系统命名是3,4-二甲基己烷 | |
| B. | 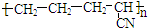 是有单体CH2=CH-CH3和CH2=CN发生加聚反应而得到的 是有单体CH2=CH-CH3和CH2=CN发生加聚反应而得到的 | |
| C. | 等质量的甲醛和乳酸[CH3CH(OH)COOH]完全燃烧消耗的氧气不相等,但生成水的质量相等 | |
| D. | 分析反应: ,由于该反应生成了不饱和化合物(含碳氧双键)和小分子,因此该反应属于消去反应 ,由于该反应生成了不饱和化合物(含碳氧双键)和小分子,因此该反应属于消去反应 |