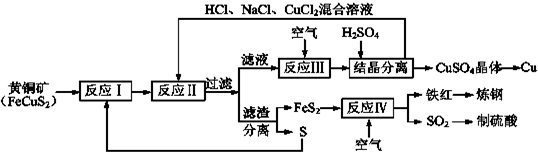
题目内容
20.下列说法正确的是( )| A. | 化学反应中的能量变化,通常表现为热量的变化 | |
| B. | 常温下氢氧化钡晶体与氯化铵晶体混合放出氨气,该反应为放热反应 | |
| C. | 酸碱反应生成1 mol水所发出的热量为中和热 | |
| D. | 旧化学键断裂所放出的能量高于新化学键形成所吸收的能量时发生放热反应 |
分析 A.化学反应往往伴随着能量的变化,能量的变化通常表现为热量的变化;
B.氢氧化钡晶体与氯化铵晶体的反应为吸热反应;
C.根据中和热的概念分析;
D.化学键断裂吸收能量,形成化学键放出能量.
解答 解:A.化学反应存在着化学键的断裂和行程,化学键断裂吸收能量,形成化学键放出能量,往往伴随着能量的变化,通常表现为热量的变化,故A正确;
B.氢氧化钡晶体与氯化铵晶体的反应为吸热反应,反应体系的温度降低,故B错误;
C.中和热是在稀溶液中强酸与强碱发生中和反应生成1mol水时所释放的热量,故C错误;
D.化学键断裂吸收能量,形成化学键放出能量,旧化学键断裂所吸收的能量高于新化学键形成所放出的能量时发生吸热反应,故D错误.
故选A.
点评 本题考查了化学反应中的能量变化、中和热的概念等知识,为高频考点,侧重于基础知识的考查,题目难度不大

练习册系列答案
相关题目
5.N2O4(无色)?2NO2(红综色),其能量变化示意图如下,则关于该反应的说法正确的是( )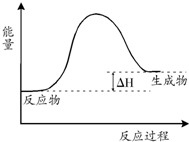

| A. | 该反应是吸热反应 | |
| B. | 当反应达到平衡时,升高温度,混合气体的颜色变浅 | |
| C. | 反应体系中加入催化剂对反应热是有影响 | |
| D. | 在反应体系中加入催化剂,正反应速率增大,逆反应速率减小 |
10.150℃时,一定质量的(NH4)2CO3完全分解产生的气体混合物的平均摩尔质量在数值上等于( )
| A. | 30.5 | B. | 26.3 | C. | 26 | D. | 24 |