题目内容
4.已知:2CH2=CH2+O2$\stackrel{一定条件}{→}$2CH3CHO.在下列反应中,其中有机反应物发生的反应类型与乙烯相同的是( )①乙醛转化为乙醇 ②苯酚置于空气中变红 ③乙醛的银镜反应 ④CH3CH2Br在NaOH醇溶液中加热
⑤丙酮(CH3COCH3)与氢气生成2-丙醇 ⑥甲苯使酸性高锰酸钾溶液褪色 ⑦乙酸乙酯碱性条件下水解.
| A. | ①⑤ | B. | ①②⑥ | C. | ②③⑥ | D. | 除④⑦ |
分析 乙烯和氧气发生加成反应生成乙醛,所以该反应的反应类型是加成反应,其中有机反应物发生的反应类型与乙烯相同,说明选项中反应应该是加成反应,据此分析解答.
解答 解:乙烯和氧气发生加成反应生成乙醛,所以该反应的反应类型是加成反应;
①乙醛转化为乙醇,是乙醛和氢气发生加成反应生成乙醇,所以是加成反应,故正确;
②苯酚置于空气中变红是因为苯酚被氧气氧化而导致的,是氧化反应,故错误;
③乙醛的银镜反应为氧化反应,故错误;
④CH3CH2Br在NaOH醇溶液中加热生成乙烯和NaBr、水,为消去反应,故错误;
⑤丙酮(CH3COCH3)与氢气生成2-丙醇,是丙酮和氢气发生加成反应生成2-丙醇,故正确;
⑥甲苯使酸性高锰酸钾溶液褪色是因为酸性高锰酸钾溶液被甲苯还原导致的,发生的是氧化还原反应,故错误;
⑦乙酸乙酯碱性条件下水解为取代反应,故错误;
故选A.
点评 本题以反应类型判断为载体考查有机物结构和性质,为高频考点,明确官能团及其性质关系、基本反应类型概念内涵及其区别是解本题关键,注意:酯的水解反应及酯化反应都属于取代反应.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
12.无色溶液既可能显酸性又可能显碱性,在该溶液中一定能大量共存的离子是( )
| A. | H+ Na+ MnO4- SO42- | B. | Na+ CO32- Mg2+Cl- | ||
| C. | K+Na+ Cl-SO42- | D. | K+ Cl-Ba2+ HCO3- |
19.下列各项与化学平衡移动原理无关的是( )
| A. | 收集Cl2用排饱和食盐水的方法 | |
| B. | 加催化剂,使SO2和O2 在一定条件下转化为SO3 | |
| C. | 可用浓氨水和NaOH(s)快速制取氨气 | |
| D. | 加压条件下有利于N2和H2反应生成NH3 |
9.下列离子方程式表达正确的是( )
| A. | 向Al2(SO4)3溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 向漂白粉稀溶液中通入过量CO2:ClO-+CO2+H2O═HClO+HCO3- | |
| C. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液使SO42-完全沉淀:NH4++Al3++SO42-+Ba2++4OH-═NH3•H2O+Al(OH)3↓+BaSO4↓ | |
| D. | 酸性溶液中KIO3与KI反应:I-+IO3-+6H+═I2+3H2O |
19.碳酸钠的用途很广,可用做冶金、纺织、漂染等工业的基本原料.请根据题意回答下列问题:
Ⅰ.世界最早工业生产碳酸钠的方法是路布兰(N.Leblanc)法.其流程如下:
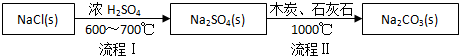
(1)流程I的另一产物是HCl,流程Ⅱ的反应分步进行:a.Na2SO4+4C $\frac{\underline{\;1000℃\;}}{\;}$Na2S+4CO↑;
b.Na2S与石灰石发生复分解反应,总反应方程式可表示为Na2SO4+4C+CaCO3$\frac{\underline{\;1000℃\;}}{\;}$Na2CO3+CaS+4CO↑.
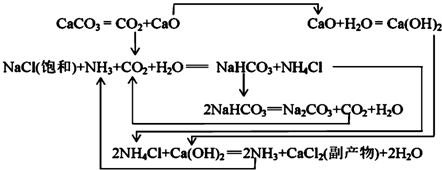
Ⅱ.1862年,比利时人索尔维(Ernest Solvay)用氨碱法生产碳酸钠.反应原理如下:
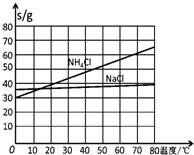
20℃时一些物质在水中的溶解度/g•(100gH2O)-1
(2)氨碱法生成纯碱的原料是食盐、水、氨气和CO2,可循环利用的物质有CaO、CO2、NH4Cl、NH3.
(3)饱和NaCl溶液通NH3和CO2能生成NaHCO3的原因有:反应体系中NaHCO3溶解度最小、反应消耗水、NaHCO3相对分子质量最大.
Ⅲ.我国化工专家侯德榜研究出联合制碱法,其反应原理和氨碱法类似,但将制氨和制碱联合,提高了原料利用率.
(4)生产中需向分离出NaHCO3后所得的溶液中加入NaCl固体并通入NH3,在0~10℃(填温度范围)下析出NH4Cl.(填化学式)
Ⅰ.世界最早工业生产碳酸钠的方法是路布兰(N.Leblanc)法.其流程如下:
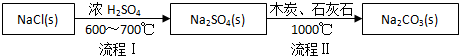
(1)流程I的另一产物是HCl,流程Ⅱ的反应分步进行:a.Na2SO4+4C $\frac{\underline{\;1000℃\;}}{\;}$Na2S+4CO↑;
b.Na2S与石灰石发生复分解反应,总反应方程式可表示为Na2SO4+4C+CaCO3$\frac{\underline{\;1000℃\;}}{\;}$Na2CO3+CaS+4CO↑.
Ⅱ.1862年,比利时人索尔维(Ernest Solvay)用氨碱法生产碳酸钠.反应原理如下:

20℃时一些物质在水中的溶解度/g•(100gH2O)-1
| NaCl | NH4Cl | NaHCO3 | NH4HCO3 | Na2CO3 |
| 35.9 | 37.2 | 9.6 | 21.7 | 21.5 |
(3)饱和NaCl溶液通NH3和CO2能生成NaHCO3的原因有:反应体系中NaHCO3溶解度最小、反应消耗水、NaHCO3相对分子质量最大.
Ⅲ.我国化工专家侯德榜研究出联合制碱法,其反应原理和氨碱法类似,但将制氨和制碱联合,提高了原料利用率.
(4)生产中需向分离出NaHCO3后所得的溶液中加入NaCl固体并通入NH3,在0~10℃(填温度范围)下析出NH4Cl.(填化学式)

20.下列说法正确的是( )
| A. | 化学反应中的能量变化,通常表现为热量的变化 | |
| B. | 常温下氢氧化钡晶体与氯化铵晶体混合放出氨气,该反应为放热反应 | |
| C. | 酸碱反应生成1 mol水所发出的热量为中和热 | |
| D. | 旧化学键断裂所放出的能量高于新化学键形成所吸收的能量时发生放热反应 |
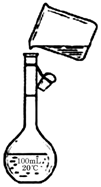 为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量): (1)实验室用如图所示装置制备少量乙酸乙酯.
(1)实验室用如图所示装置制备少量乙酸乙酯.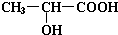 .试回答:
.试回答: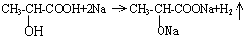 ;
;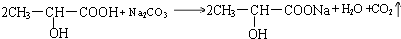 .
.