题目内容
18.根据图示转化关系,下列说法不正确是( )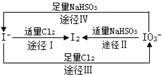
| A. | 由图可知离子还原性的强弱顺序为HSO3->I->Cl- | |
| B. | 足量Cl2能使湿润的淀粉-KI试纸先变蓝后变白 | |
| C. | 途径Ⅱ、Ⅳ反应后溶液的pH均减小 | |
| D. | 途径Ⅲ中若氧化1 mol I-,需消耗67.2L氯气 |
分析 A.氧化还原反应中还原剂的还原性大于还原产物的还原性;
B.根据图示转化Ⅲ可知Cl2>NaIO3,氯气可以将碘氧化HIO3;
C.根据反应的方程式判断;
D.途径Ⅲ中若氧化1 mol I-,转移6mol电子,需要3mol氯气,但不知气体是否存在于标准状况下.
解答 解:A.氧化还原反应中还原剂的还原性大于还原产物的还原性,由途径Ⅳ可知还原性HSO3->I-,由途径Ⅰ可知还原性I->Cl-,故A正确;
B.氧化性Cl2>NaIO3,发生5Cl2+I2+6H2O═2HClO3+10HCl,可使已变蓝的淀粉-KI试纸褪色,故B正确;
C.途径Ⅱ、Ⅳ反应的离子方程式分别为2IO3-+5HSO3-═I2+5SO42-+3H++H2O、IO3-+3HSO3-═I-+3SO42-+3H+,反应后溶液的pH均减小,故C正确;
D.途径Ⅲ中若氧化1 mol I-,转移6mol电子,需要3mol氯气,但不知气体是否存在于标准状况下,故D错误.
故选D.
点评 本题考查氧化还原反应的计算,为高考常见题型和高频考点,侧重于学生的分析能力和计算能力的考查,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,难度不大.

练习册系列答案
相关题目
8.下列说法中正确的是( )
| A. | 常温下,pH均等于4的硫酸溶液与醋酸溶液,两种溶液中c(SO42-)与c(CH3COO-)之比为1:2 | |
| B. | 常温下,向pH=4.0的醋酸溶液中加入水稀释后,溶液中c(H+)和c(OH-)都将变小 | |
| C. | 常温下,0.1mol/L NaHA溶液的PH=5,溶液:c(HA-)>c(H+)>c(H2A)>c(A2-) | |
| D. | 0.1mol•L-1的(NH4)2Fe(SO4)2溶液中:c(NH4+)=c(SO42-)>c(Fe2+)>c(H+) |
9.常温下能与浓硫酸发生剧烈反应的金属单质是( )
| A. | Cu | B. | C | C. | Fe | D. | Mg |
6.下列说法正确的是( )
| A. | 镁着火后可用二氧化碳灭火器进行灭火 | |
| B. | 焰色反应时,先用稀硫酸洗涤铂丝并在酒精灯火焰上灼烧,然后再进行实验 | |
| C. | 食盐水中混有Mg2+、Ca2+、SO42-,可依次加入过量Ba(OH)2溶液、Na2CO3溶液和适量盐酸,过滤后即可得到精制的食盐水 | |
| D. | 现代化学分析测试中,常借助一些仪器来分析化学物质的组成.如用原子吸收光谱确定物质中含有哪些金属元素 |
13.下列叙述正确的是( )
| A. |  用于干燥氯气 | B. |  用于配制一定浓度的硫酸溶液 | ||
| C. |  用于制备并收集少量NO2气体 | D. |  用于测定一定质量镁铝合金的组成 |
10.在3BrF3+5H2O═HBrO3+Br2+9HF+SO2反应中,若有5mol H2O作还原剂,铜被水还原的BrF3的物质的量为( )
| A. | 3mol | B. | 2mol | C. | $\frac{4}{3}$mol | D. | $\frac{10}{3}$mol |
5.已知X、Y、Z、W(含同一元素)有如下转化关系:

且X能与W发生反应生成一种易溶于水的盐,则X可能是( )

且X能与W发生反应生成一种易溶于水的盐,则X可能是( )
| A. | N2 | B. | NO2 | C. | NH3 | D. | NO |
6.下列物质的溶液既能与H+ 反应,又能与OH- 反应的是( )
| A. | CuSO4 | B. | Na2CO3 | C. | NaHCO3 | D. | FeCl3 |
 .
.