题目内容
9.常温下能与浓硫酸发生剧烈反应的金属单质是( )| A. | Cu | B. | C | C. | Fe | D. | Mg |
分析 A、铜与浓硫酸在加热的条件下才反应;
B、碳与浓硫酸在加热的条件下反应产生刺激性气味的气体;
C、铁与冷的浓硫酸发生钝化现象;
D、常温下能镁与浓硫酸发生剧烈反应.
解答 解:A、铜与浓硫酸在加热的条件下才反应,常温下不反应,故A不选;
B、碳与浓硫酸在加热的条件下反应产生刺激性气味的气体,故B不选;
C、铁与冷的浓硫酸发生钝化现象,加热的条件下发生反应,故C不选;
D、常温下能镁与浓硫酸发生剧烈反应,符合条件,故D正确;
故选D.
点评 本题考查金属与浓硫酸的反应,明确金属的活泼性来分析发生的反应即可解答,注意常温下Fe、Al不能完全溶解在浓硫酸中,为学生解答的易错点.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
19.下列实验事实不能用勒夏特列原理解释的是( )
| A. |
| |||||||||
| B. |
| |||||||||
| C. | 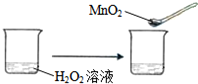 | |||||||||
| D. | 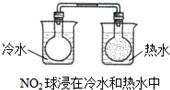 |
20.下列说法正确的是( )
| A. | 煤经过气化和液化等物理变化可以转化为清洁燃料 | |
| B. | 淀粉和蛋白质水解的最终产物都能发生银镜反应 | |
| C. | 油脂都是高级脂肪酸甘油酯,在碱性条件下能发生皂化反应 | |
| D. | “乙醇汽油”是在汽油里加入适量乙醇而成的一种燃料,它是一种新型化合物 |
17.下列各组离子,在强酸性溶液中能大量共存的是( )
| A. | Na+、K+、Ca2+、HCO3- | B. | NO3-、Cl-、Na+、Ag+ | ||
| C. | Cu2+、Fe2+、SO42-、Cl- | D. | Mg2+、Na+、Cl-、CH3COO- |
14.下列化学用语表述正确的是( )
| A. | 甲烷的球棍模型: | B. | 氯化氢的电子式: | ||
| C. | Cl2的结构式:Cl=Cl | D. | 硫离子的结构示意图: |
1.下列物质发生反应时,不因为反应的条件、反应物浓度或反应物的用量不同,而产物不同的是( )
| A. | 钠与氧气 | B. | 碳与氧气 | C. | 硅和氯气 | D. | 铁和硫酸 |
18.根据图示转化关系,下列说法不正确是( )
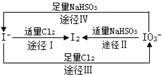

| A. | 由图可知离子还原性的强弱顺序为HSO3->I->Cl- | |
| B. | 足量Cl2能使湿润的淀粉-KI试纸先变蓝后变白 | |
| C. | 途径Ⅱ、Ⅳ反应后溶液的pH均减小 | |
| D. | 途径Ⅲ中若氧化1 mol I-,需消耗67.2L氯气 |
17.设NA为阿伏加德罗常数的值,对反应:
①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=-a kJ/mol
②CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H2=-b kJ/mol
(a、b均为正值),其他数据如表所示:
下列说法正确的是( )
①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=-a kJ/mol
②CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H2=-b kJ/mol
(a、b均为正值),其他数据如表所示:
| 化学键 | C=O | O=O | C-H | O-H |
| 键能/kJ•mol-1 | 798 | x | 413 | 463 |
| A. | H2O(g)═H2O(l)△S<0,△H=(a-b)kJ/mol | |
| B. | 当有4NA个C-H键断裂时,该反应放出热量一定为a kJ | |
| C. | x=$\frac{1796-b}{2}$ | |
| D. | 利用反应①设计的原电池电解精炼铜时,当负极输出0.2NA个电子时,电解槽的阳极一定减轻6.4g |
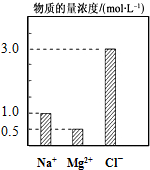 在200mL由NaCl、MgCl2、KCl组成的混合液中,部分离子浓度大小如图所示,回答下列问题:
在200mL由NaCl、MgCl2、KCl组成的混合液中,部分离子浓度大小如图所示,回答下列问题: