题目内容
相同温度下,根据三种酸的电离平衡常数,下列判断正确的是( )
| 酸 | HX | HY | HZ |
| K/mol.L-1 | 9×10-7 | 9×10-6 | 2×10-2 |
| A、三种酸的强弱关系:HX>HY>HZ |
| B、反应 HZ+Y-═HY+Z-能够发生 |
| C、相同温度下,0.1mol.L-1的NaX、NaY、NaZ溶液,NaZ溶液pH最大 |
| D、相同温度下,1 mol.L-1HX溶液的电离常数大于0.1 mol?L?1HX |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:相同温度下,酸的电离常数越大,则酸的电离程度越大,酸的酸性越强,则酸根离子水解程度越小,结合强酸制取弱酸分析解答.
解答:
解:A.相同温度下,酸的电离常数越大,则酸的电离程度越大,酸的酸性越强,则酸根离子水解程度越小,根据电离平衡常数知,这三种酸的强弱顺序是HZ>HY>HX,故A错误;
B.由A知,HZ的酸性大于HY,根据强酸制取弱酸知,HZ+Y-═HY+Z-能发生,故B正确;
C.根据电离平衡常数知,这三种酸的强弱顺序是HZ>HY>HX,酸的电离程度越大,酸根离子水解程度越小,则相同浓度的钠盐溶液,酸根离子水解程度越大的溶液其碱性越强,所以0.1 mol/L的NaX、NaY、NaZ溶液,NaZ溶液pH最小,故C错误;
D.相同温度下,同一物质的电离平衡常数不变,故D错误;
故选B.
B.由A知,HZ的酸性大于HY,根据强酸制取弱酸知,HZ+Y-═HY+Z-能发生,故B正确;
C.根据电离平衡常数知,这三种酸的强弱顺序是HZ>HY>HX,酸的电离程度越大,酸根离子水解程度越小,则相同浓度的钠盐溶液,酸根离子水解程度越大的溶液其碱性越强,所以0.1 mol/L的NaX、NaY、NaZ溶液,NaZ溶液pH最小,故C错误;
D.相同温度下,同一物质的电离平衡常数不变,故D错误;
故选B.
点评:本题考查了弱电解质的电离,明确相同温度下电离平衡常数与电解质强弱的关系是解本题关键,易错选项是D,注意温度不变,同一物质的电离平衡常数不变,与溶液的浓度无关,为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
常温下,下列电解质溶液的有关叙述正确的是( )
| A、新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) |
| B、pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-) |
| C、pH═11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+) |
| D、同浓度同体积的强酸与强碱溶液混合后,溶液的pH=7 |
提供人体所需热能的最主要物质是( )
| A、蛋白质 | B、淀粉 | C、油脂 | D、水 |
利用反应:2NO(g)+2CO?2CO2(g)+N2(g)△H=-746.8KJ?mol-1可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是( )
| A、降低温度 |
| B、增大压强 |
| C、升高温度同时充入N2 |
| D、用时将CO2和N2从反应体系中移走 |
100mL浓度为2mol/L的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气总量,可采用的方法是( )
| A、加入少量浓盐酸 |
| B、加入几滴氯化铜溶液 |
| C、加入少量铁粉 |
| D、加入适量的氯化钠溶液 |
下列说法中不正确的是( )
| A、离子晶体中不一定含有金属元素 |
| B、晶格能越大,物质的硬度反而越小 |
| C、在含有阳离子的化合物晶体中,一定含有阴离子 |
| D、原子晶体的熔点不一定比金属晶体的高 |
若某基态原子的外围电子排布为3d54s1,则下列说法正确的是( )
| A、该元素基态原子中共有7个电子 |
| B、该元素原子核外有3个电子层 |
| C、该元素原子M能层共有5个电子 |
| D、该元素原子最外层可能有1个或2个电子 |
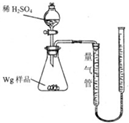 用如图所示装置测定Fe和Fe2O3的混合物中单质铁的质量分数(夹持部分已略去).称取Wg样品置于锥形瓶中,通过分液漏斗加入足量稀硫酸使样品完全溶解.实验前量气管起始读数为a mL,实验后量气管的最终读数为b mL.
用如图所示装置测定Fe和Fe2O3的混合物中单质铁的质量分数(夹持部分已略去).称取Wg样品置于锥形瓶中,通过分液漏斗加入足量稀硫酸使样品完全溶解.实验前量气管起始读数为a mL,实验后量气管的最终读数为b mL.