题目内容
已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用如图中的装置可以实现该反应.

回答下列问题:
(1)A中发生反应的化学方程式是 .
(2)B中加入的干燥剂是(填序号) ①浓硫酸 ②无水氯化钙 ③碱石灰
(3)能证明氨与氧化铜反应的现象是①C中 ,②D中有无色液体生成设计实验检验D中无色液体的成分:取少量 粉末,现象为 .
(4)写出氨气与氧化铜反应化学方程式 若收集到2.24L(STP)氮气,计算转移电子数为 .

回答下列问题:
(1)A中发生反应的化学方程式是
(2)B中加入的干燥剂是(填序号)
(3)能证明氨与氧化铜反应的现象是①C中
(4)写出氨气与氧化铜反应化学方程式
考点:氨的化学性质,氨的制取和性质
专题:实验设计题,元素及其化合物
分析:(1)依据装置图分析判断,制备氨气是实验室制备氨气的实验装置氯化铵和氢氧化钙混合加热反应生成氨气,写出化学方程式;
(2)B中是干燥氨气的装置,浓硫酸、氯化钙都和氨气反应,所以需要选择碱石灰干燥;
(3)氨可以与灼热的氧化铜反应得到氮气和金属铜,C中黑色氧化铜变化为红色铜,D中冷却得到水,检验水用无水硫酸铜;
(4)依据化学方程式中 元素化合价变化计算得到转移电子数.
(2)B中是干燥氨气的装置,浓硫酸、氯化钙都和氨气反应,所以需要选择碱石灰干燥;
(3)氨可以与灼热的氧化铜反应得到氮气和金属铜,C中黑色氧化铜变化为红色铜,D中冷却得到水,检验水用无水硫酸铜;
(4)依据化学方程式中 元素化合价变化计算得到转移电子数.
解答:
解:(1)装置图分析判断,制备氨气是实验室制备氨气的实验装置氯化铵和氢氧化钙混合加热反应生成氨气,反应的化学方程式为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;
(2)B中是干燥氨气的装置,浓硫酸、氯化钙都和氨气反应,所以需要选择碱石灰干燥,
故答案为:③;
(3)依据原子守恒配平化学方程式,2NH3+3CuO
3Cu+N2+3H2O,反应过程中C装置中固体由黑色变红色,证明氨与氧化铜反应,D中有无色液体生成说明生成水,检验水用无水硫酸铜,现象白色变蓝色或变蓝;故答案为:黑色粉末变红;无水硫酸铜;白色变蓝色或变蓝;
(4)2NH3+3CuO
3Cu+N2+3H2O,反应中生成1mol氮气转移电子6mole-,反应中生成2.8g氮气物质的量为0.1mol,转移电子为0.6mol即0.6NA,
故答案为:2NH3+3CuO
3Cu+N2↑+3H2O;0.6NA.
| ||
故答案为:2NH4Cl+Ca(OH)2
| ||
(2)B中是干燥氨气的装置,浓硫酸、氯化钙都和氨气反应,所以需要选择碱石灰干燥,
故答案为:③;
(3)依据原子守恒配平化学方程式,2NH3+3CuO
| ||
(4)2NH3+3CuO
| ||
故答案为:2NH3+3CuO
| ||
点评:本题考查了实验验证物质性质,分析反应产物的方法,实验设计的应用,仔细审题,应用题干信息是解题关键,题目难度中等.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、100℃纯水的pH<7,说明升温可导致水呈酸性 |
| B、0.2 mol?L-1的盐酸与等体积水混合后pH=1 |
| C、能自发进行的化学反应,一定是△H<0△S>0 |
| D、Na2CO3溶液中:c(Na+)+c(H+)═c(HCO3-)+c(CO32-)+c(OH-) |
等物质的量的SO2和SO3相比较,下列结论错误的是( )
| A、分子数之比为1:1 |
| B、所含原子数之比为2:3 |
| C、质量之比为1:1 |
| D、氧原子数之比为2:3 |
我国是世界上严重缺碘的地区,全国有约四亿多人缺碘,因此我国政府规定:国内销售的食盐必须加碘,食盐中加的碘是什么物质( )
| A、I2 |
| B、KI |
| C、KIO3 |
| D、I- |
下列说法中正确的是( )
| A、H2SO4 的摩尔质量是 98 g |
| B、1 mol H2O的质量是 18 g/mol |
| C、Cl-的摩尔质量是 35.5 g/mol |
| D、1 mol H2O中含有2 mol H和1 mol O |




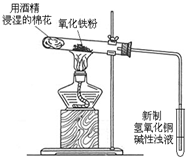 某课外小组同学做了如下探究实验:将蘸有饱和氯化铁溶液的粉笔,用坩埚钳夹持置于酒精灯火焰上灼烧,一分钟内可观察到如下颜色变化:黄色(氯化铁溶液)--红褐色(A)--铁锈红色(B)--黑色(C).
某课外小组同学做了如下探究实验:将蘸有饱和氯化铁溶液的粉笔,用坩埚钳夹持置于酒精灯火焰上灼烧,一分钟内可观察到如下颜色变化:黄色(氯化铁溶液)--红褐色(A)--铁锈红色(B)--黑色(C).