题目内容
下列物质性质的比较中,正确的是( )
| A、原子半径:C>N>O |
| B、熔点:SiO2>CO2>H2O |
| C、热稳定性:NaHCO3>Na2CO3>H2CO3 |
| D、氧化性:Na+>Mg2+>Al3+ |
考点:同一周期内元素性质的递变规律与原子结构的关系,同一主族内元素性质递变规律与原子结构的关系
专题:
分析:A.同周期,原子序数大的原子半径小;
B.原子晶体的熔点很高,分子晶体的熔点较低;
C.碳酸钠稳定,碳酸氢钠不稳定受热易分解,碳酸常温即可分解;
D.金属性越强,对应的阳离子的氧化性越弱.
B.原子晶体的熔点很高,分子晶体的熔点较低;
C.碳酸钠稳定,碳酸氢钠不稳定受热易分解,碳酸常温即可分解;
D.金属性越强,对应的阳离子的氧化性越弱.
解答:
解:A.同周期,原子序数大的原子半径小,则原子半径为C>N>O,故A正确;
B.SiO2属于原子晶体熔点很高,CO2、H2O属于分子晶体,熔点较低,水分子之间含有氢键熔点比二氧化碳高,则熔点:SiO2>H2O>CO2,故B错误;
C.碳酸钠稳定,碳酸氢钠不稳定受热易分解,碳酸常温即可分解,则热稳定性:Na2CO3>NaHCO3>H2CO3,故C错误;
D.金属性越强,对应的阳离子的氧化性越弱,金属性为Na>Mg>Al,则氧化性:Na+<Mg2+<Al3+,故D错误;
故选A.
B.SiO2属于原子晶体熔点很高,CO2、H2O属于分子晶体,熔点较低,水分子之间含有氢键熔点比二氧化碳高,则熔点:SiO2>H2O>CO2,故B错误;
C.碳酸钠稳定,碳酸氢钠不稳定受热易分解,碳酸常温即可分解,则热稳定性:Na2CO3>NaHCO3>H2CO3,故C错误;
D.金属性越强,对应的阳离子的氧化性越弱,金属性为Na>Mg>Al,则氧化性:Na+<Mg2+<Al3+,故D错误;
故选A.
点评:本题考查元素周期表和元素周期律的应用,把握元素的位置、性质及元素周期律为解答的关键,注重规律性知识的考查,题目难度不大.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、100℃纯水的pH<7,说明升温可导致水呈酸性 |
| B、0.2 mol?L-1的盐酸与等体积水混合后pH=1 |
| C、能自发进行的化学反应,一定是△H<0△S>0 |
| D、Na2CO3溶液中:c(Na+)+c(H+)═c(HCO3-)+c(CO32-)+c(OH-) |
下列方程式书写正确的是( )
| A、HCO3-的电离方程式:HCO3-+H2O═H2CO3+OH- |
| B、NH3?H2O的电离方程式:NH3?H2O?NH4++OH- |
| C、CO32-的水解方程式:CO32-+2H2O?H2CO3+2OH- |
| D、NH4Cl的水解方程式:NH4++H2O═NH3?H2O+H+ |
下列实验操作或实验所得出的结论正确的是( )
A、 实验室中浓硝酸应保存在棕色细口瓶中,并贴有如图所示标签 |
| B、制备Fe(OH)3胶体时,应向沸水中逐滴加入1mol?L-1的FeCl3溶液,并继续加热到液体呈透明的红褐色为止 |
| C、用托盘天平称取5.85g NaCl,称量时砝码放在右盘,氯化钠放在左盘 |
| D、用50mL量筒量取5.6mL浓硫酸 |
| E、用四氯化碳萃取碘水中的碘,分液时有机层从分液漏斗的下端放出 |
| F、用广泛pH试纸测得某溶液的pH为4.8 |
下列说法不正确的是( )
| A、2,3-二甲基-4-乙基己烷的名称是正确的 |
| B、有机物CH3CO18OH和C2H5OH发生酯化反应的产物为CH3CO18OC2H5和H2O |
C、肌醇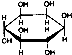 与葡萄糖 与葡萄糖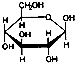 均含有六元环,互为同分异构体 均含有六元环,互为同分异构体 |
D、有机物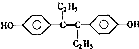 能发生加成反应,氧化反应和还原反应 能发生加成反应,氧化反应和还原反应 |
等物质的量的SO2和SO3相比较,下列结论错误的是( )
| A、分子数之比为1:1 |
| B、所含原子数之比为2:3 |
| C、质量之比为1:1 |
| D、氧原子数之比为2:3 |




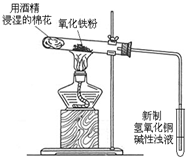 某课外小组同学做了如下探究实验:将蘸有饱和氯化铁溶液的粉笔,用坩埚钳夹持置于酒精灯火焰上灼烧,一分钟内可观察到如下颜色变化:黄色(氯化铁溶液)--红褐色(A)--铁锈红色(B)--黑色(C).
某课外小组同学做了如下探究实验:将蘸有饱和氯化铁溶液的粉笔,用坩埚钳夹持置于酒精灯火焰上灼烧,一分钟内可观察到如下颜色变化:黄色(氯化铁溶液)--红褐色(A)--铁锈红色(B)--黑色(C).