题目内容
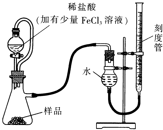 镁(MgO2)易溶于稀酸,溶于酸后会产生过氧化氢,在医学上可作为“解酸剂”等.过氧化镁产品中常会混有一定量的MgO,实验室可通过多种方案测定样品中过氧化镁的含量.某研究小组拟用如图装置测定一定质量的样品中过氧化镁的含量.
镁(MgO2)易溶于稀酸,溶于酸后会产生过氧化氢,在医学上可作为“解酸剂”等.过氧化镁产品中常会混有一定量的MgO,实验室可通过多种方案测定样品中过氧化镁的含量.某研究小组拟用如图装置测定一定质量的样品中过氧化镁的含量.(1)实验前需进行的操作是:
(2)用恒压分液漏斗的优点有:
①
实验结束时,待恢复至室温,先
实验室还可通过下列两种方案来测定样品中过氧化镁的含量:
方案I:取a g样品,加入足量稀盐酸,充分反应后再加入 NaOH溶液至Mg2+沉淀完全,过滤、洗涤后,将滤渣充分灼烧,最终得到b g固体.
(3)推算该样品中过氧化镁的质量分数
方案Ⅱ:称取0.1g样品置于某定量用锥形瓶中,加入15mL 0.6mol/L KI溶液和足量盐酸,摇匀后在暗处静置5min,然后用0.1mol/L Na2S2O3溶液滴定,滴定到终点时共消耗28.5mL Na2S2O3溶液.(已知:I2+2Na2S2O3→Na2S4O6+2NaI)
(4)该实验在滴定前需加入少量
(5)推算该样品中过氧化镁的质量分数为
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)实验前需进行的操作是检查装置的气密性;通过测量双氧水分解生成的氧气,可检测过氧化镁的含量,而氯化铁能作催化剂加快双氧水的分解,加快反应速率;
(2)体的体积受温度和压强影响大,所以用恒压分液漏斗的优点还有消除滴入溶液的体积对所测气体体积的影响,使分液漏斗中的溶液顺利滴下;
应该将右侧刻度管缓缓向下移动直到两侧液面相平,然后再平视刻度线读数;
(3)质量b是氧化镁,质量a是过氧化镁和氧化镁杂质质量,设出二者物质的量,列式计算出各自物质的量,最后根据过氧化镁的物质的量计算过氧化镁的质量分数;
(4)由于碘遇淀粉显蓝色,加入少量淀粉溶液作指示剂;
(5)根据电子守恒找出关系式,计算出过氧化镁的质量分数.
(2)体的体积受温度和压强影响大,所以用恒压分液漏斗的优点还有消除滴入溶液的体积对所测气体体积的影响,使分液漏斗中的溶液顺利滴下;
应该将右侧刻度管缓缓向下移动直到两侧液面相平,然后再平视刻度线读数;
(3)质量b是氧化镁,质量a是过氧化镁和氧化镁杂质质量,设出二者物质的量,列式计算出各自物质的量,最后根据过氧化镁的物质的量计算过氧化镁的质量分数;
(4)由于碘遇淀粉显蓝色,加入少量淀粉溶液作指示剂;
(5)根据电子守恒找出关系式,计算出过氧化镁的质量分数.
解答:
解:(1)实验装置连接好以后,实验前需进行的操作是检查装置的气密性;过氧化镁溶于水生成双氧水,双氧水易分解,通过测量双氧水分解生成的氧气,可检测过氧化镁的含量,而氯化铁能作催化剂加快双氧水的分解,加快反应速率,
故答案为:检查装置的气密性;用作催化剂(或催化H2O2的分解);
(2)由于气体的体积受温度和压强影响大,所以用恒压分液漏斗的优点还有消除滴入溶液的体积对所测气体体积的影响,使分液漏斗中的溶液顺利滴下,
由于气体大体积受压强影响大,所以在读数之前,应该将右侧刻度管缓缓向下移动直到两侧液面相平,然后再平视刻度线读数;
故答案为:消除滴入溶液的体积对所测气体体积的影响;使分液漏斗中的溶液顺利滴下;将右侧刻度管缓缓向下移动直到两侧液面相平;
(3)设过氧化镁的物质的量是xmol,氧化镁物质的量是ymol,则56x+40y=a,(x+y)×40=b,解得x=
,方案I中过氧化镁的质量分数为:
=
,
故答案是:
;
(4)过氧化镁具有氧化性,能把碘化钾氧化生成单质碘,然后利用硫代硫酸钠滴定生成的单质碘即可,由于碘遇淀粉显蓝色,加入少量淀粉溶液作指示剂,判断到达滴定终点的现象是蓝色变无色;
故答案为:淀粉溶液;蓝色变无色;
(5)根据反应方程式:I2+2Na2S2O3=Na2S4O6+2NaI,根据电子守恒找出关系式:MgO2~I2,所以n(MgO2)=n(I2)=
n(Na2S2O3)=
×0.1mol/L×28.5×10-3L=1.425×10-3mol,
过氧化镁的质量分数是:
×100%=79.8%=0.798,
故答案为:0.798.
故答案为:检查装置的气密性;用作催化剂(或催化H2O2的分解);
(2)由于气体的体积受温度和压强影响大,所以用恒压分液漏斗的优点还有消除滴入溶液的体积对所测气体体积的影响,使分液漏斗中的溶液顺利滴下,
由于气体大体积受压强影响大,所以在读数之前,应该将右侧刻度管缓缓向下移动直到两侧液面相平,然后再平视刻度线读数;
故答案为:消除滴入溶液的体积对所测气体体积的影响;使分液漏斗中的溶液顺利滴下;将右侧刻度管缓缓向下移动直到两侧液面相平;
(3)设过氧化镁的物质的量是xmol,氧化镁物质的量是ymol,则56x+40y=a,(x+y)×40=b,解得x=
| a-b |
| 16 |
| ||
| a |
| 7(a-b) |
| 2a |
故答案是:
| 7(a-b) |
| 2a |
(4)过氧化镁具有氧化性,能把碘化钾氧化生成单质碘,然后利用硫代硫酸钠滴定生成的单质碘即可,由于碘遇淀粉显蓝色,加入少量淀粉溶液作指示剂,判断到达滴定终点的现象是蓝色变无色;
故答案为:淀粉溶液;蓝色变无色;
(5)根据反应方程式:I2+2Na2S2O3=Na2S4O6+2NaI,根据电子守恒找出关系式:MgO2~I2,所以n(MgO2)=n(I2)=
| 1 |
| 2 |
| 1 |
| 2 |
过氧化镁的质量分数是:
| 1.425×10-3×56g/mol |
| 0.1g |
故答案为:0.798.
点评:该题是高考中的常见题型,属于中等难度的试题,试题综合性强,侧重对学生能力的培养和训练,有利于培养学生规范严谨的实验设计、操作能力;该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力.

练习册系列答案
相关题目
设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A、1molNa2O2固体中含离子总数为4NA | ||||
| B、常温下,5.6gFe与足量稀HNO3反应,转移0.2NA个电子 | ||||
| C、常温常压下,5.6g乙烯与丁烯的混合物中含有的氢原子的数目为0.8NA | ||||
D、5NH4NO3
|
闪电时空气中的N2和O2会发生反应:N2(g)+2O2(g)═2NO2(g)△H=+180.50kJ/mol,△S=247.3J/(mol?K),若不考虑温度对该反应焓变的影响,则下列说法中正确的是( )
| A、在1 000℃时,此反应能自发进行 |
| B、在1 000℃时,此反应不能自发进行 |
| C、该反应能自发进行的最低温度约为730℃ |
| D、该反应能自发进行的最高温度约为730 K |
下列实验操作中,溶液里不可能有固体析出的是( )
| A、MgCl2溶液中加入一粒绿豆大小的Na |
| B、饱和Ca(OH)2溶液中加入一粒绿豆大小的Na |
| C、CuSO4溶液中加入一粒绿豆大小的Na |
| D、水中加入一粒绿豆大小的Na |
 已知X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图所示,下列说法正确的是( )
已知X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图所示,下列说法正确的是( )| A、Z元素的原子半径可能比Y元素的小 |
| B、Z的原子序数不可能是X的原子序数的2倍 |
| C、W的气态氢化物的稳定性一定比Y的强 |
| D、Z的最高价氧化物的水化物的酸性一定比W的强 |