题目内容
15.下列各种冶炼方法中,可制得相应金属的为( )| A. | 氢气还原氧化镁 | B. | 加热碳酸钙 | C. | CO还原氧化铁 | D. | 电解饱和食盐水 |
分析 金属的冶炼方法有电解法、热还原法、热分解法等,电解法:冶炼活泼金属K、Ca、Na、Mg、Al,一般用电解熔融的氯化物(Al是电解熔融的三氧化二铝)制得;热还原法:冶炼较不活泼的金属Zn、Fe、Sn、Pb、Cu,常用还原剂有(C、CO、H2等);热分解法:Hg、Ag用加热分解氧化物的方法制得,物理分离法:Pt、Au用物理分离的方法制得,据此解答.
解答 解:A.镁的还原性强于氢气,不能通过氢气还原氧化镁制取镁,应采用电解熔融氯化镁的方法制取镁,故A错误;
B.加热碳酸钙生成氧化钙和二氧化碳,得不到钙,钙性质活泼,应采用电解熔融氯化钙的方法制取钙,故B错误;
C.铁性质较活泼,用还原法即可制取铁,故C正确;
D.电解饱和食盐水生成氢氧化钠、氢气和氯气,得不到钠,钠性质活泼,应采用电解熔融氯化钠的方法制取钠,故D错误;
故选:C.
点评 本题考查了金属的冶炼,根据金属的活泼性采用相应的冶炼方法,难度不大.

练习册系列答案
相关题目
1.常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:
(1)2Fe2++H2O2+2H+═2Fe3++2H2O (2)2Fe3++H2O2═2Fe2++O2↑+2H+
下列说法不正确的是( )
(1)2Fe2++H2O2+2H+═2Fe3++2H2O (2)2Fe3++H2O2═2Fe2++O2↑+2H+
下列说法不正确的是( )
| A. | (1)中H2O2的氧化性比Fe3+强,其还原性比Fe2+弱 | |
| B. | 在反应过程中,溶液的H+浓度不变 | |
| C. | 在反应过程中,Fe2+和Fe3+的总量保持不变 | |
| D. | H2O2生产过程要严格避免混入Fe2+ |
6.实验室测定酸碱反应的反应热时,不需要用到的玻璃仪器是( )
| A. | 试管 | B. | 温度计 | C. | 烧杯 | D. | 环型玻璃搅拌棒 |
3.某药物中间体的合成路线如下.下列说法正确的是( )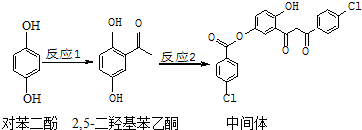

| A. | 对苯二酚在空气中能稳定存在 | |
| B. | 1mol该中间体最多可与11 molH2反应 | |
| C. | 2,5-二羟基苯乙酮能发生加成、取代、缩聚反应 | |
| D. | 该中间体分子中含有1个手性碳原子 |
10.NA表示阿伏伽德罗常数,下列说法正确的是( )
| A. | 1mol过氧化钠中阴离子数目为2NA | |
| B. | 1mol氯气与足量的NaOH溶液反应,转移电子的数目为2 NA | |
| C. | 标准状况下,11.2L氨水含有0.5 NA个NH3分子 | |
| D. | 9g水中含有5 NA个电子 |
7.有关常温下pH均为3的酸酸和硫酸的说法正确的是( )
| A. | 分别加水稀释100倍后,两种溶液的pH仍相同 | |
| B. | 醋酸中的c(CH3COO-)和硫酸中的c(SO42-)相等 | |
| C. | 分别加入足量锌片,两种溶液生成H2的体积相同 | |
| D. | 两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol•L-1 |
4.能正确表示下列反应的离子方程式是( )
| A. | 硫氢化钠的水解反应 HS-+H2O?S2-+H3O+ | |
| B. | 碳酸氢钙与过量的 NaOH 溶液反应 Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| C. | Na2O2与H2O反应制备O2 Na2O2+H2O═2Na++2OH-+O2↑ | |
| D. | 向碳酸钠溶液中加少量盐酸 CO32-+2H+═H2O+CO2↑ |
5.列物质灼烧时,火焰呈黄色的是( )
| A. | NaCl | B. | K2SO4 | C. | CaCl2 | D. | CuSO4 |
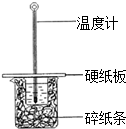 某学生实验小组用50mL0.50mol•L-1的盐酸与50mL0.50mol•L-1的NaOH溶液在如图所示的装置中进行中和反应反应热的测定
某学生实验小组用50mL0.50mol•L-1的盐酸与50mL0.50mol•L-1的NaOH溶液在如图所示的装置中进行中和反应反应热的测定