题目内容
12.在25℃时,将c mol•L-1的醋酸溶液与0.02mol•L-1NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=$\frac{2×1{0}^{-9}}{c-0.02}$,.分析 常温下两溶液反应后呈中性,则c(H+)=c(OH-)=10-7mol/L,c(Na+)=c(CH3COO-)=0.01mol/L,据此结合醋酸的电离平衡常数表达式计算.
解答 解:反应后溶液呈中性,则c(H+)=c(OH-)=10-7mol/L,c(Na+)=c(CH3COO-)=0.01mol/L,
根据物料守恒,反应后溶液中醋酸的浓度为:($\frac{c}{2}$-0.1)mol/L,
所以用含c的代数式表示CH3COOH的电离常数为:Ka=$\frac{1{0}^{-7}×0.01}{\frac{c}{2}-0.01}$=$\frac{2×1{0}^{-9}}{c-0.02}$,
故答案为:$\frac{2×1{0}^{-9}}{c-0.02}$.
点评 本题考查了电离平衡常数的计算,题目难度不大,明确电离平衡常数的概念及表达式为解答关键,注意掌握溶液酸碱性与溶液pH的关系,试题培养了学生的分析、理解能力及化学计算能力.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案
相关题目
2.有机物:①CH2═CHCH2CH═CHCOOH②CH2═CHCOOCH3③CH2═CHCH2OH④CH3CH2CH2OH中均能发生酯化反应、加成反应和氧化反应的是( )
| A. | ①③④ | B. | ②④ | C. | ①③ | D. | ①② |
3.下列各组离子,在水溶液中能大量共存的是( )
(1)I-、ClO-、NO3-、H+
(2)k+、Ag(NH3)2+、NO3-、H+
(3)NH4+、SO42-、Cl-、HCO3-
(4)Fe3+、Cu2+、SO42-、Cl-
(5)H+、k+、AlO2-、C6H15O-
(6)Pb2+、Na+、SO42-、NO3-.
(1)I-、ClO-、NO3-、H+
(2)k+、Ag(NH3)2+、NO3-、H+
(3)NH4+、SO42-、Cl-、HCO3-
(4)Fe3+、Cu2+、SO42-、Cl-
(5)H+、k+、AlO2-、C6H15O-
(6)Pb2+、Na+、SO42-、NO3-.
| A. | (1)和(6) | B. | (3)和(4) | C. | (2)和(4) | D. | (2)和(5) |
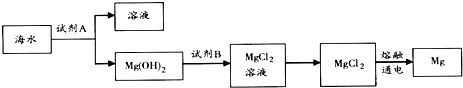
20.除金、铂等极少数金属外,绝大多数金属元素以化合物形式存在于自然界中,将金属元素从其化合物中还原出来的工业工程称为金属的冶炼.下列材料描述了一些常见金属的冶炼方法.
①工业上冶炼镁的方法有两种,电解法和皮江法.电解法是电解熔融的氯化镁;皮江法是硅在高温下还原氧化镁.
②霍尔-埃鲁铝电解法是以氧化铝为原料、冰晶石(Na3AlF6)为熔剂组成的电解质,在950-970℃的条件下通过电解的方法使电解质熔体中的氧化铝分解为铝和氧气.
③湿法炼铜是工业上常用的一种炼铜的方法.使用铁和硫酸铜溶液反应.
④工业上冶炼银的方法是加热条件下让氧化银分解.
⑤冶炼锰一般用铝热法,即在高温下用铝还原二氧化锰.
⑥相关各物质熔点见如表
Ⅰ根据上述信息回答下列问题:
(1)影响金属冶炼方法的首要因素是金属的活泼性.
(2)冶炼镁时电解熔融MgCl2而不电解熔融MgO,冶炼铝时电解熔融Al2O3而不电解熔融AlCl3的原因是MgO的熔点比MgCl2的熔点高,MgO熔融时耗费更多能源,增加成本;AlCl3属于共价化合物,熔融状态下不导电,故不能电解AlCl3.
(3)写出铝热法冶炼锰的化学方程式4Al+3MnO2$\frac{\underline{\;高温\;}}{\;}$2Al2O3+3Mn,一般使用铝热法冶炼的金属具有哪些性质熔点高且比铝不活泼的金属.
Ⅱ如面是皮江法冶炼镁的工业流程示意图

(1)气体a是CO2.
(2)白云石煅烧前粉碎的目的是增大固体表面积,提高反应速率.
(3)还原炉需控制温度为1200℃左右,并抽空气到近似真空,还原炉中发生的主要反应有2MgO+Si$\frac{\underline{\;高温\;}}{\;}$2Mg↑+SiO2、SiO2+CaO$\frac{\underline{\;高温\;}}{\;}$CaSiO3.
(4)还原炉中抽空气到近似真空的原因是防止已还原的Mg在高温条件下再次被氧化.
①工业上冶炼镁的方法有两种,电解法和皮江法.电解法是电解熔融的氯化镁;皮江法是硅在高温下还原氧化镁.
②霍尔-埃鲁铝电解法是以氧化铝为原料、冰晶石(Na3AlF6)为熔剂组成的电解质,在950-970℃的条件下通过电解的方法使电解质熔体中的氧化铝分解为铝和氧气.
③湿法炼铜是工业上常用的一种炼铜的方法.使用铁和硫酸铜溶液反应.
④工业上冶炼银的方法是加热条件下让氧化银分解.
⑤冶炼锰一般用铝热法,即在高温下用铝还原二氧化锰.
⑥相关各物质熔点见如表
| 物质 | Al2O3 | AlCl3 | MgO | MgCl2 | Al | Mn | Mg |
| 熔点/℃ | 2303 | 190 | 2800 | 712 | 660 | 1244 | 649 |
(1)影响金属冶炼方法的首要因素是金属的活泼性.
(2)冶炼镁时电解熔融MgCl2而不电解熔融MgO,冶炼铝时电解熔融Al2O3而不电解熔融AlCl3的原因是MgO的熔点比MgCl2的熔点高,MgO熔融时耗费更多能源,增加成本;AlCl3属于共价化合物,熔融状态下不导电,故不能电解AlCl3.
(3)写出铝热法冶炼锰的化学方程式4Al+3MnO2$\frac{\underline{\;高温\;}}{\;}$2Al2O3+3Mn,一般使用铝热法冶炼的金属具有哪些性质熔点高且比铝不活泼的金属.
Ⅱ如面是皮江法冶炼镁的工业流程示意图

(1)气体a是CO2.
(2)白云石煅烧前粉碎的目的是增大固体表面积,提高反应速率.
(3)还原炉需控制温度为1200℃左右,并抽空气到近似真空,还原炉中发生的主要反应有2MgO+Si$\frac{\underline{\;高温\;}}{\;}$2Mg↑+SiO2、SiO2+CaO$\frac{\underline{\;高温\;}}{\;}$CaSiO3.
(4)还原炉中抽空气到近似真空的原因是防止已还原的Mg在高温条件下再次被氧化.
7.下列各组离子在指定溶液中,一定能大量共存的是( )
| A. | 在由水电离出的c(OH-)=1×10-13mol/L的溶液中:Na+、Al3+、Cl-、NO3- | |
| B. | 在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、NO3- | |
| C. | 在澄清透明的溶液中:Cu2+、K+、SO42-、Cl- | |
| D. | 在能使甲基橙变黄色的溶液中:Na+、CO32-、NO3-、K+ |
1.下列是除去括号内杂质的有关操作,其中正确的是( )
| A. | 乙醇(乙酸)--加水,振荡静置后分液 | |
| B. | SO2(CO2)--氢氧化钠溶液 | |
| C. | 乙烯(乙炔)--将气体通过盛KMnO4溶液的洗气瓶 | |
| D. | 苯(苯酚)--加足量NaOH溶液,振荡静置后分液 |