题目内容
14.下列有关反应X+2Y=X2++2Y-的叙述中正确的是( )| A. | X被氧化,Y 是氧化剂 | B. | Y被还原,X是氧化剂 | ||
| C. | X是还原剂,Y被氧化 | D. | Y被还原,X2+是还原产物 |
分析 X+2Y═X2++2Y-中,X的化合价升高,Y的化合价降低,结合氧化还原反应基本概念来解答.
解答 解:A.Y的化合价降低,则为氧化剂;X的化合价升高,被氧化,故A正确;
B.Y的化合价降低,则为氧化剂被还原,X的化合价升高,为还原剂,故B错误;
C.X的化合价升高,Y的化合价降低,则X为还原剂,Y为氧化剂,Y被还原,故C错误;
D.Y的化合价降低,则为氧化剂,被还原;X的化合价升高,被氧化,则X2+是氧化产物,故D错误;
故选A.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化是解答本题的关键,侧重氧化还原反应基本概念的考查,题目难度不大.

练习册系列答案
相关题目
5.原子序数依次增大的短周期主族元素A、B、C、D,A元素的一种同位素原子核内无中子;B元素形成的化合物种类最多;C、D元素同主族且最外层电子数为偶数.下列叙述正确的是( )
| A. | A元素形成的双原子分子A2最多有3种 | |
| B. | 化合物BC2的电子式为 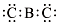 | |
| C. | B、C、D三种元素的非金属性强弱顺序为C>D>B | |
| D. | 化合物A2C的沸点高于A2D是因为C-A键比D-A键稳定 |
2.设NA为阿伏加德罗常数的值.下列有关叙述正确的是( )
| A. | 27g铝中加入lmol/L的NaOH溶液,转移电子数是3NA | |
| B. | 原子总数是4NA的N2与CO混合物,其质量是56g | |
| C. | Na2O2和KMnO4分别制得1molO2,转移的电子数均是2NA | |
| D. | 标准状况下,44.8L NO与22.4 L O2反应后的分子数是2NA |
9.下列叙述正确的是( )
| A. | 铜丝能导电,因此它是电解质 | |
| B. | BaSO4难溶于水,因此它是非电解质 | |
| C. | NaC1熔融状态时能导电,因此它是电解质 | |
| D. | 胶体区别于其他分散系的本质是具有丁达尔效应 |
19.水热法制备纳米化合物Y的反应为:3Fe2++2S2O32-+O2+aOH-=Y+S4O62-+2H2O.下列说法中不正确的是
( )
( )
| A. | a=4 | |
| B. | S2O32-是氧化剂 | |
| C. | Y的化学式为Fe3O4 | |
| D. | 当有1 molO2参加反应时,转移电子的物质的量为4 mol |
6.己知:100℃的溫度下,水的离子积Kw=1×10-12.下列说法正确的是( )
| A. | 0.05mol/L 的 H2SO4溶液 PH=1 | |
| B. | 0.001mol/L 的 NaOH溶液 PH=11 | |
| C. | 0.005mol/L的H2SO4溶液与0.0lmol/LNaOH溶液等体积浪合,混合液pH=6,溶液呈酸性 | |
| D. | 完全中和PH=3的H2SO4溶液50mL,需要pH=11的NaOH溶液50mL |
3.化学与生活、社会密切相关.下列说法不正确的是( )
| A. | 制备单晶硅的过程中不发生氧化还原反应 | |
| B. | 绚丽缤纷的烟花中添加了含钾,钙,钠,铜等金属元素化合物 | |
| C. | SiO2、NaOH、HF三者两两均能反应 | |
| D. | 氢氧化铝可作胃酸的中和剂 |