题目内容
4.常温下,pH=12的NaOH溶液与pH=2的硫酸,若等体积混合后,溶液的pH为7;若按9:11的体积比混合后,溶液的pH为3;若按11:9的体积比混合后,溶液的pH为11.分析 先计算判断氢离子和氢氧根离子的物质的量相对大小,再根据溶液的酸碱性计算溶液的pH.
若混合后显中性,则pH=7;
若混合后显酸性,则直接求氢离子浓度,然后求pH;
若混合后显碱性,则先求氢氧根离子浓度,然后求氢离子浓度,再求pH.
解答 解:常温下,pH=12的NaOH中c(OH-)=0.01mol/L,pH=2的HCl中c(H+)=0.01mol/L,等体积混合后,酸和碱的物质的量相等,则溶液呈中性,pH=7;
若二者以体积比9:11混合,则硫酸过量,溶液呈酸性,混合溶液中c(H+)=$\frac{0.01mol/L×11L-0.01mol/L×9L}{20L}$=10-3mol/L,则溶液的pH=3;
若二者以体积比11:9混合,则氢氧化钠过量,溶液呈碱性,混合溶液中c(OH-)=$\frac{0.01mol/L×11L-0.01mol/L×9L}{20L}$=10-3mol/L,则溶液中的c(H+)=$\frac{1{0}^{-14}}{1{0}^{-3}}$=10-11mol/L,则溶液的pH=11.
故答案为:7;3;11.
点评 本题考查了酸碱反应后溶液的PH计算分析应用,掌握反应实质和判断出混合后溶液的酸碱性是解题关键.

练习册系列答案
相关题目
20.以下转化过程可以一步实现的是( )
| A. | SO2→H2SO4 | B. | SiO2→H2SiO3 | C. | Al2O3→Al(OH)3 | D. | Fe2O3→Fe(OH)3 |
15.将8.7gMnO2固体和5.85g食盐混合,再加入过量浓硫酸加热可放出气体,该气体与过量KI反应,生成的I2用Na2S2O3溶液吸收:I2+2Na2S2O3→2NaI+Na2S4O6,若要将生成的I2全部吸收,则需1mol/L的Na2S2O3溶液( )
| A. | 50mL | B. | 33.3mL | C. | 100mL | D. | 66.7mL |
12.对“AgCl(s)?Ag+(aq)+Cl-(aq)”的理解正确的是( )
| A. | 说明AgCl没有完全电离,AgCl是弱电解质 | |
| B. | 说明溶解的AgCl已完全电离,是强电解质 | |
| C. | 说明Ag+与Cl-反应不能完全进行到底 | |
| D. | 说明AgCl(s)与Ag+、Cl-共存,v溶解=v沉淀=0 |
19.在Al3++3H2O?Al(OH)3+3H+的平衡体系中,要使平衡向水解方向移动.且使溶液的pH增大,应采取的措施是( )
| A. | 加热 | B. | 通入HCl | ||
| C. | 加入适量的NaOH(固体) | D. | 加入固体NaCl |
14.下列有关反应X+2Y=X2++2Y-的叙述中正确的是( )
| A. | X被氧化,Y 是氧化剂 | B. | Y被还原,X是氧化剂 | ||
| C. | X是还原剂,Y被氧化 | D. | Y被还原,X2+是还原产物 |
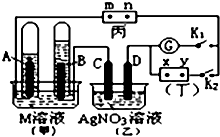 如图所示的实验装置,丙为用淀粉碘化钾和酚酞混合溶液润湿的滤纸,m、n为夹在滤纸两端的铂夹.丁为直流电源,x、y为电源的两极.G为电流计,电极均为石墨电极.闭合K2、断开K1,一段时间后,A、B两极产生的气体体积之比为2:1,回答下列问题:
如图所示的实验装置,丙为用淀粉碘化钾和酚酞混合溶液润湿的滤纸,m、n为夹在滤纸两端的铂夹.丁为直流电源,x、y为电源的两极.G为电流计,电极均为石墨电极.闭合K2、断开K1,一段时间后,A、B两极产生的气体体积之比为2:1,回答下列问题: