题目内容
 按要求填空
按要求填空(1)a、e属于短周期的同族元素,a的原子半径最小,e的原子半径最大(稀有气体除外),写出它们组成化合物的化学式
(2)C、N、O的第一电离能由大到小的顺序为
(3)AsH3空间形状为
考点:判断简单分子或离子的构型,元素周期律的作用,原子轨道杂化方式及杂化类型判断
专题:元素周期律与元素周期表专题
分析:(1)a、e属于短周期的同族元素,a的原子半径最小,e的原子半径最大(稀有气体除外),则a是H元素、e是Na元素,二者通过得失电子形成NaH,活泼金属和活泼非金属元素之间易形成离子键;
(2)同一周期元素,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素;
O元素的电负性大于N元素的电负性;
(3)根据价层电子对互斥理论确定AsH3空间构型、(CH3)3Ga中Ga原子的杂化方式;等电子体结构相似,根据氮气分子的电子式书写O22+的电子式.
(2)同一周期元素,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素;
O元素的电负性大于N元素的电负性;
(3)根据价层电子对互斥理论确定AsH3空间构型、(CH3)3Ga中Ga原子的杂化方式;等电子体结构相似,根据氮气分子的电子式书写O22+的电子式.
解答:
解:(1)a、e属于短周期的同族元素,a的原子半径最小,e的原子半径最大(稀有气体除外),则a是H元素、e是Na元素,二者通过得失电子形成NaH,NaH是由钠离子和氢离子构成,所以NaH中含有离子键,故答案为:NaH;离子键;
(2)同一周期元素,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素,所以C、N、O三种元素的第一电离能大小顺序是N>O>C;
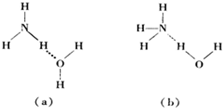
O元素的电负性大于N元素的电负性,则水中的H原子为裸露的质子,则形成的NH3?H2O的合理结构为(b),
故答案为:N>O>C;(b);
(3)AsH3中砷原子有3对成键电子对且1个孤电子对,所以它的空间构型是三角锥形;由于Ga原子周围只有3对成键电子对,故其杂化方法为sp2,根据等电子体原理可知,O22+的电子式 ,
,
故答案为:三角锥形;sp2; .
.
(2)同一周期元素,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素,所以C、N、O三种元素的第一电离能大小顺序是N>O>C;
O元素的电负性大于N元素的电负性,则水中的H原子为裸露的质子,则形成的NH3?H2O的合理结构为(b),
故答案为:N>O>C;(b);
(3)AsH3中砷原子有3对成键电子对且1个孤电子对,所以它的空间构型是三角锥形;由于Ga原子周围只有3对成键电子对,故其杂化方法为sp2,根据等电子体原理可知,O22+的电子式
 ,
,故答案为:三角锥形;sp2;
 .
.
点评:本题考查了微粒空间构型的判断、原子杂化方式的判断、等电子体等知识点,这些考点都是考试热点,要熟练掌握,根据价层电子对互斥理论、元素周期律等知识点来分析解答,题目难度不大.

练习册系列答案
相关题目
下列化学反应不属于氧化还原反应的是( )
| A、实验室制氢气 |
| B、实验室制氧气 |
| C、实验室制二氧化碳 |
| D、炭在空气中燃烧 |
R2O8n-离子在一定条件下可把Mn2+氧化成MnO4-,若反应后R2O8n-变成RO42-,又知反应中氧化剂与还原剂的离子个数比为5:2,则R2O8n-离子中R元素的化合价以及n值分别为( )
| A、+7、2 | B、+6、2 |
| C、+5、1 | D、+4、1 |