题目内容
.在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0
(1)写出该反应的化学平衡常数表达式K= .
(2)降低温度,该反应K值 ,二氧化硫转化率 (以上均填“增大”、“减小”或“不变”).
(1)写出该反应的化学平衡常数表达式K=
(2)降低温度,该反应K值
考点:化学平衡的影响因素,化学平衡常数的含义
专题:化学平衡专题
分析:(1)依据化学方程式和平衡常数概念书写表达式;
(2)反应是放热反应,降低温度平衡正向进行,平衡常数增大,二氧化硫转化率增大;
(2)反应是放热反应,降低温度平衡正向进行,平衡常数增大,二氧化硫转化率增大;
解答:
解:(1)2SO2(g)+O2(g)?2SO3(g),反应的平衡常数K=
;
故答案为:
;
(2)2SO2(g)+O2(g)?2SO3(g)△H<0,反应是放热反应,降低温度平衡正向进行,平衡常数增大,二氧化硫转化率增大;
故答案为:增大; 增大;
| c2(SO3) |
| c2(SO2)c(O2) |
故答案为:
| c2(SO3) |
| c2(SO2)c(O2) |
(2)2SO2(g)+O2(g)?2SO3(g)△H<0,反应是放热反应,降低温度平衡正向进行,平衡常数增大,二氧化硫转化率增大;
故答案为:增大; 增大;
点评:本题考查了化学平衡常数书写,影响化学平衡因素分析判断,掌握平衡移动原理是解题关键,题目较简单.

练习册系列答案
相关题目
下列叙述中,错误的是( )
| A、某自发的化学反应,若△S<0,则该自发反应一定为放热反应 |
| B、利用电化学原理保护金属的一种方法是把被保护金属作为阳极,而另一比其更活泼的金属作为阴极 |
| C、对于反应2NH3(g)?N2(g)+3H2(g),减小体积增大压强,反应物活化分子数及活化分子百分数均不发生改变 |
| D、改变条件,使化学平衡往正向移动,反应物的转化率不一定增大 |
将50mL 0.3mol?L-1 NaOH溶液加水稀释到300mL,稀释后溶液中NaOH的物质的量浓度为( )
| A、0.03mol?L-1 |
| B、0.05mol?L-1 |
| C、0.5mol?L-1 |
| D、0.04mol?L-1 |
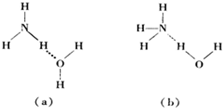 按要求填空
按要求填空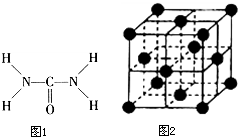 如图1,已知尿素的结构式为:尿素可用于制有机铁肥,主要代表物有三硝酸,六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6]
如图1,已知尿素的结构式为:尿素可用于制有机铁肥,主要代表物有三硝酸,六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6]