题目内容
3.用下列实验装置完成对应的实验(部分仪器已省略》,能达到实验目的是(已知HCl、NH3是极易溶于水的气体)( )| A. | 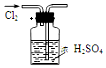 干燥Cl2 | B. |  吸收HCl | ||
| C. |  用自来水制蒸馏水 | D. |  吸收NH3 |
分析 A.干燥装置中导气管应该遵循“长进短出”原则;
B.易产生倒吸;
C.温度计位置错误;
D.氨气不溶于四氯化碳,可防止倒吸.
解答 解:A.干燥装置中导气管应该遵循“长进短出”原则,否则易排出浓硫酸,故A错误;
B.导管插入液面以下,易产生倒吸,故B错误;
C.温度计用于测量馏分的温度,应位于蒸馏烧瓶的支管口,故C错误;
D.氨气不溶于四氯化碳,且与水不接触,可防止倒吸,故D正确.
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握实验装置的作用、物质的性质、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
10.用价层电子对互斥理论预测SCl2和PF3的立体构型,两个结构都正确的是( )
| A. | 直线形、三角锥形 | B. | V形、三角锥形 | ||
| C. | V形、平面三角形 | D. | 直线形、平面三角形 |
14.下列说法正确的是( )
(1)3H2(g)+N2(g)?2NH3(g)该反应为熵增反应
(2)增加硫酸的浓度,一定可以加快锌与硫酸反应制取氢气的速率
(3)对于反应CaCO3(s)?CaO(s)+CO2(g),增加CaCO3的量,可以加快正反应速率,而增加CaO或CO2的浓度,则可以加快逆反应速率
(4)对于反应3H2(g)+N2(g)?2NH3(g),在密闭容器中进行(固定体积),充入氦气,压强增大,则化学反应速率加快
(5)对于反应3H2(g)+N2(g)?2NH3(g),使用催化剂,正逆反应速率同等程度加快.
(1)3H2(g)+N2(g)?2NH3(g)该反应为熵增反应
(2)增加硫酸的浓度,一定可以加快锌与硫酸反应制取氢气的速率
(3)对于反应CaCO3(s)?CaO(s)+CO2(g),增加CaCO3的量,可以加快正反应速率,而增加CaO或CO2的浓度,则可以加快逆反应速率
(4)对于反应3H2(g)+N2(g)?2NH3(g),在密闭容器中进行(固定体积),充入氦气,压强增大,则化学反应速率加快
(5)对于反应3H2(g)+N2(g)?2NH3(g),使用催化剂,正逆反应速率同等程度加快.
| A. | (1)(2) | B. | (1)(2)(3) | C. | (1)(2)(3)(4) | D. | (5) |
11.将1-氯丙烷跟NaOH的醇溶液共热后,生成的产物再跟溴水反应,得到的该有机物是 ( )
| A. | CH3-CH2-CHBr2 | B. |  | C. |  | D. |  |
15.某物质灼烧时,焰色反应为黄色,下列判断中正确的是( )
| A. | 该物质中一定只含钠元素 | B. | 该物质一定含钠元素,没有钾元素 | ||
| C. | 不能确定该物质中是否含钾元素 | D. | 该物质一定是金属钠 |
13.下列说法正确的是( )
| A. | 钠原子与氯原子反应生成NaCl后,其结构的稳定性增强 | |
| B. | 阴、阳离子之间有强烈的吸引作用而没有排斥作用,所以离子键的核间距离相当小 | |
| C. | 失电子难的原子获得电子的能力一定强 | |
| D. | 任何离子键在形成的过程中必定有电子的得与失 |
 海水是盐的“故乡”,海水中含有各种盐类,其中70%为氯化钠,另外还含有氯化镁、硫酸镁等.某化学兴趣小组为了从海水中分离出氯化钠,设计了如下实验方案:
海水是盐的“故乡”,海水中含有各种盐类,其中70%为氯化钠,另外还含有氯化镁、硫酸镁等.某化学兴趣小组为了从海水中分离出氯化钠,设计了如下实验方案: