题目内容
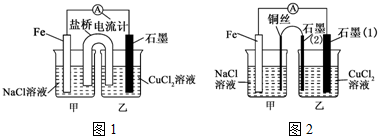
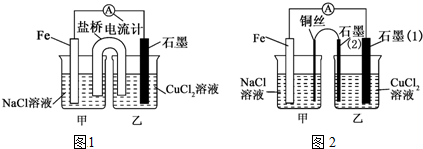
12.化学工业在经济发展中的作用举足轻重,下列有关工业生产的叙述中,正确的是( )| A. | 硫酸生产中常采用高压条件提高SO2的转化率 | |
| B. | 合成氨中采用及时分离氨气提高反应速率 | |
| C. | 电解精炼铜时,溶液中c(Cu2+)会略有减小 | |
| D. | 氯碱工业电解饱和食盐水时,阳极得到氢氧化钠和氢气 |
分析 A、SO2与O2的反应常压下转化率已经很高,高压提高了生成成本;
B、将NH3及时液化分离浓度减小,速率减小;
C、电解精炼铜时,阳极活泼性比铜弱强的金属先失电子,在阴极上是铜离子得电子的反应;
D、电解池的阳极上是阴离子发生失电子的氧化反应.
解答 解:A、采用常压条件的原因是,常压条件二氧化硫的转化率已经很大,高压转化率增大不多,但是提高了生成成本,故A错误;
B、合成氨工业中,将NH3及时液化分离,浓度减小,速率减小,故B错误;
C、电解精炼铜时,阳极活泼性比铜弱强的金属先失电子,在阴极上是铜离子得电子的反应,点解后,溶液中c(Cu2+)会略有减小,故C正确;
D、电解池的阳极上是阴离子氯离子发生失电子的氧化反应,即生成氯气,而阴极得到氢氧化钠和氢气,故D错误.
故选C.
点评 本题考查学生电解池的工作原理以及影响化学反应速率的因素等知识,考查学生分析和解决问题的能力,难度不大.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
7.下列叙述正确的是( )
| A. | 0.1mol/L醋酸溶液中:c(H+)=c(CH3COO- )+c(OH- ) | |
| B. | 中和pH与体积都相同的硫酸和醋酸,消耗NaOH的量后者大于前者 | |
| C. | 由水电离的H+浓度为1.0×10-4mol/L的溶液,pH一定等于4 | |
| D. | NaHCO3溶液中:c(Na+)>c(HCO3-)>c(H2CO3)>c(OH-)>c(H+) |
1.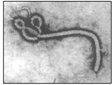 “埃博拉”病毒的形状宛如中国古代的“如意”(如图).病毒的基本化学组成是核酸和蛋白质.有的病毒还含有脂质、糖类等其他组分.下列有关有机物的说法不正确的是( )
“埃博拉”病毒的形状宛如中国古代的“如意”(如图).病毒的基本化学组成是核酸和蛋白质.有的病毒还含有脂质、糖类等其他组分.下列有关有机物的说法不正确的是( )
 “埃博拉”病毒的形状宛如中国古代的“如意”(如图).病毒的基本化学组成是核酸和蛋白质.有的病毒还含有脂质、糖类等其他组分.下列有关有机物的说法不正确的是( )
“埃博拉”病毒的形状宛如中国古代的“如意”(如图).病毒的基本化学组成是核酸和蛋白质.有的病毒还含有脂质、糖类等其他组分.下列有关有机物的说法不正确的是( )| A. | 漂白粉、双氧水都可以杀灭埃博拉病毒 | |
| B. | 组成病毒的糖类、酯类和蛋白质在一定条件下都可发生水解反应 | |
| C. | 酯在酸性条件下的水解反应属于取代反应,也属于可逆反应 | |
| D. | 糖类和蛋白质的燃烧产物不同 |
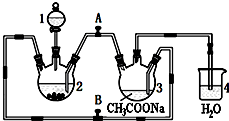 醋酸亚铬水合物{[Cr(CH3COO)2]2•2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂.实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如右图所示,且仪器2中预先加入锌粒.已知二价铬不稳定,极易被氧气氧化,不与锌反应.制备过程中发生的相关反应如下:
醋酸亚铬水合物{[Cr(CH3COO)2]2•2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂.实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如右图所示,且仪器2中预先加入锌粒.已知二价铬不稳定,极易被氧气氧化,不与锌反应.制备过程中发生的相关反应如下: .
.
 .
.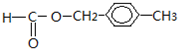 .
.