题目内容
(1)对于下列反应:2SO2+O2?2SO3,如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用SO2浓度变化来表示的化学反应速率为 ,用O2浓度变化来表示的反应速率为 .如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L?min),那么2min时SO2的浓度为 .
(2)下图表示在密闭容器中反应:2SO2+O2?2SO3△H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是 ;b c过程中改变的条件可能是 ; 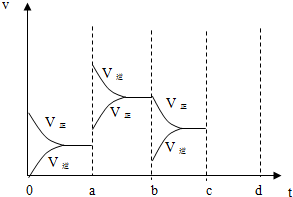
(2)下图表示在密闭容器中反应:2SO2+O2?2SO3△H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是

考点:化学平衡的计算,反应速率的定量表示方法,化学反应速率与化学平衡图象的综合应用
专题:化学平衡专题
分析:(1)根据v=
计算化学反应速率,根据同一化学反应中同一时间段内各物质的反应速率之比等于其计量数之比计算二氧化硫的反应速率,速率之比等于化学方程式计量数之比计算氧气反应速率,根据反应速率计算二氧化硫反应量,从而得出2min时SO2的浓度;
(2)根据正逆反应速率的变化结合温度、压强对反应速率和化学平衡的影响判断,a时逆反应速率大于正反应速率,且正逆反应速率都增大,b时正反应速率大于逆反应速率,注意逆反应速率突然减小的特点;
| △c |
| △t |
(2)根据正逆反应速率的变化结合温度、压强对反应速率和化学平衡的影响判断,a时逆反应速率大于正反应速率,且正逆反应速率都增大,b时正反应速率大于逆反应速率,注意逆反应速率突然减小的特点;
解答:
解:(1)用SO2浓度变化来表示的化学反应速率为v=
=
=2mol/(L?min),v(O2)=
v(SO2)=1mol/(L?min),同一化学反应中同一时间段内各物质的反应速率之比等于其计量数之比,所以二氧化硫的反应速率是氧气的2倍为1mol/(L?min),2min内二氧化硫浓度的变化量为1mol/(L?min)×2min=2mol/L,则二氧化硫的平衡浓度=4mol/L-2mol/L=2mol/L,
故答案为:2mol/(L?min);1mol/(L?min);2mol/L;
(2)a时逆反应速率大于正反应速率,且正逆反应速率都增大,说明平衡应向逆反应方向移动,该反应的正反应放热,应为升高温度的结果,b时正反应速率不变,逆反应速率减小,在此基础上逐渐减小,应为减小生成物的原因,若增大压强时,平衡向正反应方向移动,则正逆反应速率都增大,且正反应速率大于逆反应速率,图象应为,
故答案为:升高温度;减小SO3浓度.
| △c |
| △t |
| 6mol/L-2mol/L |
| 2min |
| 1 |
| 2 |
故答案为:2mol/(L?min);1mol/(L?min);2mol/L;
(2)a时逆反应速率大于正反应速率,且正逆反应速率都增大,说明平衡应向逆反应方向移动,该反应的正反应放热,应为升高温度的结果,b时正反应速率不变,逆反应速率减小,在此基础上逐渐减小,应为减小生成物的原因,若增大压强时,平衡向正反应方向移动,则正逆反应速率都增大,且正反应速率大于逆反应速率,图象应为,
故答案为:升高温度;减小SO3浓度.
点评:本题考查化学平衡移动的影响因素,题目难度中等,解答本题的关键是正确判断化学方程式的特征,结合外界条件对平衡移动的影响分析图象.

练习册系列答案
相关题目
用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加快的是( )
| A、加热 |
| B、改用硝酸 |
| C、滴加少量CuCl2溶液 |
| D、不用铁片,改用铁粉 |
室温时,下列混合溶液的pH一定小于7的是( )
| A、pH=3的盐酸和pH=11的氨水等体积混合 |
| B、pH=1的硫酸和0.2 mol/L的氢氧化钠溶液等体积混合 |
| C、pH=3的醋酸和 pH=11 的氢氧化钠溶液等体积混合 |
| D、0.1 mol/L的硫酸和0.2 mol/L的氨水等体积混合 |
设NA为阿伏加德罗常数的数值,下列说法中正确的是( )
| A、在密闭容器中加入l.5mol H2和0.5molN2,充分反应后可得到NH3分子数为NA |
| B、常温下,1 L 0.1 mol?L-1 的NH4NO3溶液中氮原子数为0.2NA |
| C、1.0L的0.1 mol?L-1Na2S溶液中含有的S2-离子数为0.1NA |
| D、用惰性电极电解饱和食盐水时,当阳极上生成11.2L气体(标况下)时,导线上转移的电子数为2NA |
下列说法正确的是( )
| A、将NaOH溶液和氨水溶液各稀释一倍,二者的OH-浓度均减小到原来的一半 |
| B、如果盐酸的浓度是醋酸浓度的两倍,则盐酸中的H+浓度是醋酸的两倍 |
| C、强电解质溶液的导电能力一定比弱电解质溶液强 |
| D、中和等体积、等物质的量浓度的盐酸和醋酸溶液,所需NaOH的物质的量相等 |