题目内容
11.在一定条件下,向一体积为2 L的恒容密闭容器中充入2mol A、1mol B,发生如下反应:2A(g)+B?3C(g)△H=-Q kJ/mol(Q>0).经过60s达到平衡,测得B物质的量为0.2mol,下列对该平衡的叙述正确的是( )| A. | 用A浓度表示该反应速率为1.6 mol/(L•min) | |
| B. | 若使容器体积变为1 L,则B的物质的量一定减小 | |
| C. | 达到平衡,测得放出热量为x kJ,则x=Q | |
| D. | 若向容器再充入1 mol C,重新达到平衡,A的体积分数保持不变,则B为气态 |
分析 依据化学平衡三段式列式计算;
2A(g)+B═3C(g);
起始量(mol) 2 1 0
变化量(mol) 1.6 0.8 2.4
平衡量(mol) 0.4 0.2 2.4
A、依据反应速率V=$\frac{△c}{△t}$计算分析;
B、若使容器变为1L,体系压强增大,若B为气体平衡不动;
C、反应是可逆反应,不能进行彻底;
D、若向容器再充入1mol C,压强增大,重新达到平衡,A的体积分数保持不变说明平衡不动,则B为气体;
解答 解:依据化学平衡三段式列式计算;
2A(g)+B═3C(g);
起始量(mol) 2 1 0
变化量(mol) 1.6 0.8 2.4
平衡量(mol) 0.4 0.2 2.4
A、C的反应速率V=$\frac{△c}{△t}$=$\frac{\frac{2.4mol}{2L}}{1min}$=1.2mol/L•min,故A错误;
B、若使容器变为1L,体系压强增大B为气体,平衡不动,C物质的量不变,若B为液体,平衡逆向进行,C物质的量减小,故B错误;
C、反应是可逆反应,不能进行彻底,达到平衡,测得放出热量为xkJ,则x<Q,故C错误;
D、若向容器再充入1mol C,压强增大,重新达到平衡,A的体积分数保持不变说明平衡不动,则B为气体,故D正确;
故选D.
点评 本题考查了化学平衡影响因素的分析判断,注意反应前后气体体积的变化,掌握基础和平衡移动原理是关键,题目难度中等.

练习册系列答案
相关题目
1.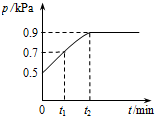 在1.0L密闭容器中放入0.10molX,在一定温度下发生反应:X(g)═Y(g)+Z(g)△H<0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析不正确的是( )
在1.0L密闭容器中放入0.10molX,在一定温度下发生反应:X(g)═Y(g)+Z(g)△H<0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析不正确的是( )
 在1.0L密闭容器中放入0.10molX,在一定温度下发生反应:X(g)═Y(g)+Z(g)△H<0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析不正确的是( )
在1.0L密闭容器中放入0.10molX,在一定温度下发生反应:X(g)═Y(g)+Z(g)△H<0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析不正确的是( )| A. | 从反应开始到t1时的平均反应速率v(X)=$\frac{0.04}{{t}_{1}}$mol/(L•min) | |
| B. | 该温度下此反应的平衡常数K=0.32 | |
| C. | 欲提高平衡体系中Y的含量,可降低体系温度或减少Z的量 | |
| D. | 其他条件不变,再充入0.1 mol 气体X,平衡正向移动,X的转化率增大 |
2.从南方往北方长途运输水果时,常常将浸泡有高锰酸钾溶液的硅藻土放置在盛放水果的容器中,其目的是利用KMnO4溶液( )
| A. | 杀死水果周围的细菌,防止水果霉变 | |
| B. | 吸收水果周围的氧气,防止水果腐烂 | |
| C. | 吸收水果产生的乙烯,防止水果早熟 | |
| D. | 氧化性较强,催熟水果 |
6.对于反应N2O4(g)?2NO2(g)△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )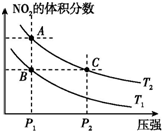

| A. | 两种不同的温度比较:T1>T2 | |
| B. | A、C两点的反应速率:A>C | |
| C. | B、C两点的气体的平均相对分子质量:B<C | |
| D. | 由状态B到状态A,可以用加热的方法实现 |
16.下列关于物质的量浓度表述正确的是( )
| A. | 0.3 mol•L-1的Na2SO4溶液中含有的Na+和SO42-的总物质的量为0.9 mol | |
| B. | 当1 L水吸收22.4 L氨气时所得氨水的浓度不是1 mol•L-1,只有当22.4 L氨气溶于水制得1 L氨水时,其浓度才是1 mol•L-1 | |
| C. | 在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同 | |
| D. | 10℃时,0.35 mol•L-1的KCl饱和溶液100 mL蒸发掉5 g水,冷却到10℃时,其体积小于100 mL,它的物质的量浓度仍为0.35 mol•L-1 |

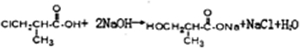 ;高分子化合物H的结构简式为
;高分子化合物H的结构简式为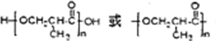 .
.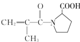 ,F有多种同分异构体,如
,F有多种同分异构体,如 等.写出满足下列条件的F的同分异构体的结构简式:
等.写出满足下列条件的F的同分异构体的结构简式: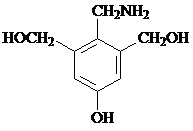 、
、 .
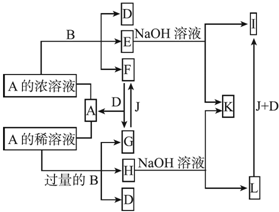
.

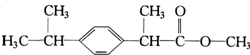 某种药物主要成分X的分子结构如图,关于有机物X的说法中错误的是( )
某种药物主要成分X的分子结构如图,关于有机物X的说法中错误的是( )