题目内容
6.对于反应N2O4(g)?2NO2(g)△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )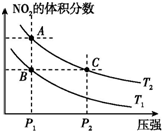
| A. | 两种不同的温度比较:T1>T2 | |
| B. | A、C两点的反应速率:A>C | |
| C. | B、C两点的气体的平均相对分子质量:B<C | |
| D. | 由状态B到状态A,可以用加热的方法实现 |
分析 N2O4(g)═2NO2(g)为吸热反应,升高温度,速率加快,化学平衡正向移动,NO2的体积分数增大;增大压强,速率加快,化学平衡逆向移动,NO2的体积分数减小,结合图象来分析解答.
解答 解:A、由图中A、B两点对比可知压强相同,对于该反应正向为吸热反应,升高温度,平衡向正向移动,NO2体积分数增大,所以A点温度高,T1<T2,故A错误;
B、由图象可知,A、C两点都在等温线上,压强越高反应速率越大,A点压强低于C点,则A、C两点的反应速率:A<C,故B错误;
C、BC两点NO2体积分数相同,即体系组成相同,所以平均相对分子质量相同,故C错误;
D、由图象可知,A、B两点都在等压线上,A点温度高,升高温度,平衡正向移动,二氧化氮的体积分数增加,由状态B到状态A,可以用加热的方法实现,故D正确;
故选D.
点评 本题考查化学平衡的图象,明确外界条件对化学平衡的影响及图象中纵横坐标的含义即可解答,难度不大.

练习册系列答案
相关题目
16.化学与生产、生活密切相关,下列叙述错误的是( )
| A. | 我国已能利用3D打印技术,以钛合金粉末为原料,通过激光熔化逐层堆积,来制造飞机钛合金结构件,高温时可用金属钠还原相应的氯化物来制取金属钛 | |
| B. | 光导纤维遇强碱会“断路” | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料 |
14.纤维素被称为第七营养素.食物中的纤维素虽然不能为人体提供能量,但能促进肠道蠕动、吸附排出有害物质.不能用于鉴别淀粉和纤维素的方法是( )
| A. | 分别加入碘水,观察颜色反应 | |
| B. | 分别加稀硫酸煮沸,再加足量NaOH溶液调至碱性,加银氨溶液加热观察有无银镜 | |
| C. | 分别加热水溶解,观察溶解性 | |
| D. | 放在嘴里咀嚼,有无甜味产生 |
1.45克油脂皂化需6克烧碱,该油脂的相对分子质量是( )
| A. | 300 | B. | 450 | C. | 850 | D. | 900 |
11.在一定条件下,向一体积为2 L的恒容密闭容器中充入2mol A、1mol B,发生如下反应:2A(g)+B?3C(g)△H=-Q kJ/mol(Q>0).经过60s达到平衡,测得B物质的量为0.2mol,下列对该平衡的叙述正确的是( )
| A. | 用A浓度表示该反应速率为1.6 mol/(L•min) | |
| B. | 若使容器体积变为1 L,则B的物质的量一定减小 | |
| C. | 达到平衡,测得放出热量为x kJ,则x=Q | |
| D. | 若向容器再充入1 mol C,重新达到平衡,A的体积分数保持不变,则B为气态 |
18.下列有关高级脂肪酸甘油酯的说法不正确的是( )
| A. | 高级脂肪酸甘油酯是高分子化合物 | |
| B. | 天然的不饱和高级脂肪酸甘油酯都是混甘油酯 | |
| C. | 植物油可以使酸性高锰酸钾溶液褪色 | |
| D. | 油脂皂化完全后原有的液体分层现象消失 |
15.有关如图所示化合物的说法不正确的是( )
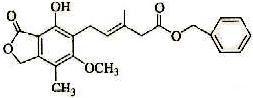

| A. | 一定条件下,既可以与Br2发生加成反应,又可以与Br2发生取代反应 | |
| B. | 1 mol该化合物最多可以与3 molNaOH反应 | |
| C. | 既可以催化加氢,又可以在稀硫酸存在下水解得2种有机物 | |
| D. | 可以与Na2CO3溶液反应放出CO2气体 |
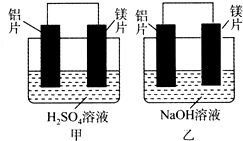 有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol•L-1的H2SO4溶液中,乙同学将电极放入6 mol•L-1的NaOH溶液中,如图所示.
有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol•L-1的H2SO4溶液中,乙同学将电极放入6 mol•L-1的NaOH溶液中,如图所示.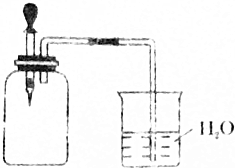 如图所示,将1molCH4与1molCl2混合后充入集气瓶内,置于光亮处,让混合气体缓慢地反应一段时间.
如图所示,将1molCH4与1molCl2混合后充入集气瓶内,置于光亮处,让混合气体缓慢地反应一段时间.