题目内容
17.设NA为阿伏伽德罗常数的数值,下列说法正确的是( )| A. | 23 g Na与足量H2O反应完全后可生成NA个H2分子 | |
| B. | 1 mol Cu和足量热浓硫酸反应可生成NA个SO3分子 | |
| C. | 标准状况下,22.4 L Cl2含NA个原子 | |
| D. | 3 mol单质Fe完全转变为Fe3O4,失去8 NA个电子 |
分析 A.钠与水反应生成氢氧化钠,1mol钠反应生成0.5mol氢气;
B.不符合反应客观事实;
C.依据n=$\frac{V}{Vm}$结合氯气为双原子分子结构解答;
D.根据Fe3O4中铁为+$\frac{8}{3}$价来分析.
解答 解:A.23 g Na物质的量为1mol,与足量H2O反应完全后可生成0.5NA个H2分子,故A错误;
B.铜与浓硫酸在加热条件下反应生成二氧化硫和硫酸铜、水,故B错误;
C.标准状况下,22.4 L Cl2物质的量为$\frac{22.4L}{22.4L/mol}$=1mol,含有2NA个原子,故C错误;
D.Fe3O4中铁为+$\frac{8}{3}$价,故1mol铁反应失去$\frac{8}{3}$mol电子,3mol单质Fe完全转化为Fe3O4失去8mol电子,即8NA个,故D正确;
故选:D.
点评 本题考查了阿伏伽德罗常数的综合应用,熟练掌握物质的量与阿伏伽德罗常数、摩尔质量等物理量之间关系是解题关键,注意浓硫酸的性质,题目难度不大.

练习册系列答案
相关题目
7.有NO2、O2的混合气体12mL,通入足量水中,充分反应后逸出气体2mL(同温同压下),则原混合气体中氧气的体积是( )
| A. | 4.8mL | B. | 2.4mL | C. | 3mL | D. | 4mL或1.2mL |
8.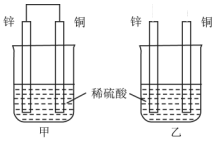 关于如图所示装置的叙述,正确的是( )
关于如图所示装置的叙述,正确的是( )
 关于如图所示装置的叙述,正确的是( )
关于如图所示装置的叙述,正确的是( )| A. | 两烧杯中铜片表面均无气泡产生 | B. | 甲中铜片是正极,乙中铜片是负极 | ||
| C. | 甲中电流由锌片经导线流向铜片 | D. | 两烧杯锌片均发生氧化反应 |
2.以下实验装置一般不用于分离物质的是( )
| A. |  | B. |  | C. |  | D. |  |
6.除去下列物质中所含的杂质,选用的试剂及方法正确的是( )
| 选项 | 物质(杂质) | 试剂 | 方法 |
| A | CO2(SO2) | 饱和Na2CO3溶液 | 洗气 |
| B | NaCl溶液(Na2CO3) | BaCl2 | 过滤 |
| C | Cl2(HCl) | 饱和NaCl溶液 | 洗气 |
| D | KI溶液(I2) | 乙醇 | 萃取分液 |
| A. | A | B. | B | C. | C | D. | D |
7.对于反应:N2+3H2?2NH3△H<0,下列叙述正确的是( )
| A. | 升高温度,逆反应速率加快,正反应速率减慢 | |
| B. | 使用催化剂比不使用催化剂化学平衡常数要大 | |
| C. | 由勒夏特列原理可知合成氨时,分离出NH3可以提高原料利用率 | |
| D. | 加压能加快反应速率,因为增加了活化分子百分数 |

 .
. .
. 和
和 ,写出另3种同分异构体的结构简式
,写出另3种同分异构体的结构简式 、
、 、
、 .
.