题目内容
1.下列A、B两种元素,其中可以组成AB2型离子化合物的是( )| A. | C和O | B. | Na和S | C. | Mg和Cl | D. | Ne和O |
分析 活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,含有离子键的化合物是离子化合物,A、B两种元素,其中可以组成AB2型离子化合物,则A为第IIA族、B为第VIIA族元素,据此分析解答.
解答 解:活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,含有离子键的化合物是离子化合物,A、B两种元素,其中可以组成AB2型离子化合物,则A为第IIA族、B为第VIIA族元素,
A.C、O元素分别位于第IVA族、第VIA族,二者只能形成共价化合物,故A错误;
B.Na、S元素分别位于第IA族、第VIA族元素,二者能形成A2B型离子化合物,故B错误;
C.Mg和Cl分别位于第IIA族、第VIIA族元素,二者能形成AB2型离子化合物,故C正确;
D.Ne位于0族元素,不易形成化合物,故D错误;
故选C.
点评 本题考查离子化合物判断,为高频考点,侧重考查基本概念及学生分析判断能力,明确离子键和共价键根本区别是解本题关键,题目难度不大.

练习册系列答案
相关题目
11.下列关于热化学的说法正确的是( )
| A. | 需要加热才能发生的反应是吸热反应 | |
| B. | 等量的硫蒸气和硫固体分别完全燃烧,前者放出热量少 | |
| C. | 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关 | |
| D. | 由热化学方程式 3H2(g)+N2(g)?2NH3(g)△H=-92 kJ/mol可知,1molN2与3molH2放入密闭容器中,在催化剂的作用下反应得到氨气,将释放92kJ热量 |
12.工业上获得大量的乙烯、丙烯和甲烷,采用的方法是( )
| A. | 石油分馏 | B. | 石油裂化 | C. | 石油裂解 | D. | 通过沼气池制取 |
9.关于如图所示的原电池,下列说法正确的是( )
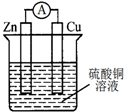

| A. | 电子从锌电极通过电流表流向铜电极 | |
| B. | 锌电极发生还原反应,铜电极发生氧化反应 | |
| C. | 反应后,锌电极的质量减小 | |
| D. | 铜电极作正极,发生的电极反应为2H++2e-═H2↑ |
16.下列叙述正确的是( )
| A. | 同主族元素自上而下金属性减弱 | |
| B. | 同主族元素自上而下,得电子能力增强 | |
| C. | 同周期元素中ⅠA族元素的原子半径最小 | |
| D. | 同周期元素中ⅦA元素气态氢化物最稳定 |
6.下列有关三氧化硫的说法中,正确的是( )
| A. | 三氧化硫极易溶于水,且与水反应生成H2SO3 | |
| B. | SO3属于酸性氧化物 | |
| C. | 硫粉在过量的氧气中燃烧生成SO3 | |
| D. | SO2、SO3均具有漂白性,能使紫色石蕊溶液褪色 |
13.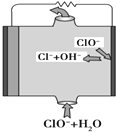 镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低等特点.一般研究的镁燃料电池可分为镁空气燃料电池、镁海水燃料电池、镁过氧化氢燃料电池和镁次氯酸盐燃料电池.其中,镁次氯酸盐燃料电池的工作原理如图所示,下列有关说法不正确的是( )
镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低等特点.一般研究的镁燃料电池可分为镁空气燃料电池、镁海水燃料电池、镁过氧化氢燃料电池和镁次氯酸盐燃料电池.其中,镁次氯酸盐燃料电池的工作原理如图所示,下列有关说法不正确的是( )
 镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低等特点.一般研究的镁燃料电池可分为镁空气燃料电池、镁海水燃料电池、镁过氧化氢燃料电池和镁次氯酸盐燃料电池.其中,镁次氯酸盐燃料电池的工作原理如图所示,下列有关说法不正确的是( )
镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低等特点.一般研究的镁燃料电池可分为镁空气燃料电池、镁海水燃料电池、镁过氧化氢燃料电池和镁次氯酸盐燃料电池.其中,镁次氯酸盐燃料电池的工作原理如图所示,下列有关说法不正确的是( )| A. | 镁燃料电池中镁均为负极,发生氧化反应 | |
| B. | 镁次氯酸盐燃料电池的总反应式为Mg+ClO-+H2O═Mg(OH)2+Cl- | |
| C. | 镁过氧化氢燃料电池,酸性电解质中正极反应式为H2O2+2H++2e-═2H2O | |
| D. | 镁次氯酸盐燃料放电过程中OH-移向正极 |
10.如图表示某高分子化合物的结构片断,关于该高分子化合物的推断正确的是( )

| A. | 该高分子是经由缩聚反应得到 | |
| B. | 该高分子的分子式是(C3H3Cl3)n | |
| C. | 聚合物的单体是CHCl=CHClCH3 | |
| D. | 若n为聚合度,则其相对分子质量为97n |