题目内容
16.下列叙述正确的是( )| A. | 同主族元素自上而下金属性减弱 | |
| B. | 同主族元素自上而下,得电子能力增强 | |
| C. | 同周期元素中ⅠA族元素的原子半径最小 | |
| D. | 同周期元素中ⅦA元素气态氢化物最稳定 |
分析 A.同主族自上而下金属性增强;
B.同主族自上而下非金属性减弱,得电子能力减弱;
C.同周期自左而右原子半径减小;
D.非金属性越强氢化物越稳定,同周期自左而右非金属性增强.
解答 解:A.同主族自上而下电子层增多,原子半径增大,原子核对最最外层电子的吸引减弱,金属性增强、非金属性减弱,故A错误;
B.同主族自上而下电子层增多,原子半径增大,原子核对最最外层电子的吸引减弱,得电子能力减弱,故B错误;
C.同周期自左而右核电荷数增大,原子核对核外电子吸引增大,原子半径减小,同周期元素中ⅠA族元素的原子半径最大,故C错误;
D.同周期自左而右非金属性增强,同周期元素中ⅦA族元素的非金属性最强,故同周期元素中ⅦA族元素的气态氢化物最稳定,故D正确;
故选D.
点评 本题考查同主族、同周期元素性质与结构的递变规律,比较基础,侧重对基础知识的巩固,注意理解递变规律.

练习册系列答案
相关题目
6. W、X、Y、Z、M、G五种短周期元素,原子序数依次增大.W,Z同主族,可形成离子化合物ZW;Y,M同主族,可形成MY2,MY3两种分子;X的气态氢化物水溶液呈碱性.
W、X、Y、Z、M、G五种短周期元素,原子序数依次增大.W,Z同主族,可形成离子化合物ZW;Y,M同主族,可形成MY2,MY3两种分子;X的气态氢化物水溶液呈碱性.
请回答下列问题:
(1)Y在元素周期表中的位置为第二周期第VIA族;
(2)上述五种元素的最高价氧化物对应的水化物酸性最强的是HClO4(写化学式)
(3)W、Y、Z、G形成的简单离子的半径大小顺序是Cl->N3->O2->Na+(用化学符号表示)
(4)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有O3、Cl2、ClO2 (任写两个)
(5)Y与M的氢化物中,热稳定性差的是H2S(填化学式),沸点高的是H2O(填化学式)
(6)ZW的电子式为Na+[:H]-,W2Y2的电子式为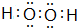 ,用电子式表示Z2M的形成过程:
,用电子式表示Z2M的形成过程: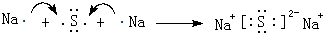 .
.
(7)MY2和G2均能使品红溶液褪色,常温常压下若将相同体积的MY2和G2气体同时通入品红溶液,品红溶液不褪色(填“褪色”或“不褪色”),请用相关离子方程式解释原因SO2+Cl2+2H2O=SO42-+2Cl-+4H+.
(8)已知
工业制镁时,电解MgCl2而不电解MgO的原因是氧化镁熔点高,耗能多;制铝时,电解Al2O3而不电解AlCl3的原因是氯化铝是共价化合物,熔融时不导电.
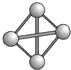
(9)最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N入出942kJ.根据以上信息和数据,下列说法正确的是C.
A.N4属于一种新型化合物
B.N4晶体熔点高,硬度大
C.相同质量的N4的能量高于N2
D.1molN4转变为N2将吸收882KJ的能量.
 W、X、Y、Z、M、G五种短周期元素,原子序数依次增大.W,Z同主族,可形成离子化合物ZW;Y,M同主族,可形成MY2,MY3两种分子;X的气态氢化物水溶液呈碱性.
W、X、Y、Z、M、G五种短周期元素,原子序数依次增大.W,Z同主族,可形成离子化合物ZW;Y,M同主族,可形成MY2,MY3两种分子;X的气态氢化物水溶液呈碱性.请回答下列问题:
(1)Y在元素周期表中的位置为第二周期第VIA族;
(2)上述五种元素的最高价氧化物对应的水化物酸性最强的是HClO4(写化学式)
(3)W、Y、Z、G形成的简单离子的半径大小顺序是Cl->N3->O2->Na+(用化学符号表示)
(4)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有O3、Cl2、ClO2 (任写两个)
(5)Y与M的氢化物中,热稳定性差的是H2S(填化学式),沸点高的是H2O(填化学式)
(6)ZW的电子式为Na+[:H]-,W2Y2的电子式为
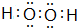 ,用电子式表示Z2M的形成过程:
,用电子式表示Z2M的形成过程: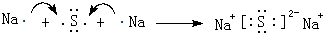 .
.(7)MY2和G2均能使品红溶液褪色,常温常压下若将相同体积的MY2和G2气体同时通入品红溶液,品红溶液不褪色(填“褪色”或“不褪色”),请用相关离子方程式解释原因SO2+Cl2+2H2O=SO42-+2Cl-+4H+.
(8)已知
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
(9)最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N入出942kJ.根据以上信息和数据,下列说法正确的是C.
A.N4属于一种新型化合物
B.N4晶体熔点高,硬度大
C.相同质量的N4的能量高于N2
D.1molN4转变为N2将吸收882KJ的能量.
7.一定量的锌粉和2mol•L-1的过量盐酸反应,当向其中加入少量的下列物质时,能够减小反应速率,又不影响产生H2总量的是( )
| A. | 石墨 | B. | 氧化铜 | C. | 浓盐酸 | D. | 醋酸钠固体 |
4.下列各指定微粒的数目比是1:1的是( )
| A. | Na2O2溶液中阴离子和阳离子 | |
| B. | NaHSO4溶液中阳离子和阴离子 | |
| C. | ${\;}_{12}^{24}$Mg2+离子中的质子和中子 | |
| D. | 氯化钠溶液中阳离子和阴离子的电子数 |
1.下列A、B两种元素,其中可以组成AB2型离子化合物的是( )
| A. | C和O | B. | Na和S | C. | Mg和Cl | D. | Ne和O |
8.下列有关化学用语或说法正确的是( )
| A. | 氯离子的结构示意图: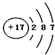 | B. | 18g18O2中含有1mol氧原子 | ||
| C. | 14N和14C是互为同位素 | D. | 氨气的电子式为: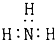 |
5.有关键能(破坏1mol共价键吸收的能量)数据如表
晶体硅在氧气中燃烧的热化学方程式为Si(s)+O2(g)═SiO2(s)△H=-989.2kJ•mol-1,则X的值为(已知1mol Si中含有2mol Si-Si键,1mol SiO2中含有4mol Si-O键)( )
| 化学键 | Si-O | O═O | Si-Si |
| 键能/kJ•mol-1 | X | 498.8 | 176 |
| A. | 34.6 | B. | 460 | C. | 832 | D. | 920 |
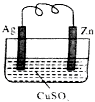 如图所示的原电池,一段时间后某极析出6.4克的固体.回答下列问题:
如图所示的原电池,一段时间后某极析出6.4克的固体.回答下列问题:
 和
和
