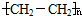题目内容
17.下列关于电解质电离的叙述中,不正确的是( )| A. | 电解质的电离过程就是产生自由移动离子的过程 | |
| B. | 碳酸钙在水中难溶,但被溶解的碳酸钙全部电离,所以碳酸钙是强电解质 | |
| C. | 氯气和氨气的水溶液导电性都很好,所以它们是强电解质 | |
| D. | 水难电离,纯水几乎不导电,所以水是弱电解质 |
分析 A.电解质在溶液中电离出自由移动的阴阳离子;
B.电解质的强弱与溶解度大小没有必然关系;
C.氯气为单质,氨水中导电离子不是氨气电离的;
D.水存在电离平衡,其电离程度较小,水属于弱电解质.
解答 解:A.电解质在溶液中能够发生电离,其电离过程就是产生自由移动离子的过程,故A正确;
B.碳酸钙难溶于水,但被溶解的碳酸钙在溶液中能够全部电离,所以碳酸钙是强电解质,故B正确;
C.氯气和氨气的水溶液导电性都很好,但是氯气为单质,氨水中导电离子不是氨气电离的,所以氯气不属于电解质,氨气为非电解质,故C错误;
D.水能够电离出氢离子和氢氧根离子,由于电离程度较小,水属于弱电解质,故D正确;
故选C.
点评 本题考查较为综合,涉及电解质的电离、电解质与非电解质、强电解质与弱电解质等知识,题目难度不大,明确强弱电解质、电解质与非电解质的概念为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
相关题目
7.下列说法正确的是( )
| A. | 同主族元素的原子序数越大,其原子半径越大 | |
| B. | 在元素周期表中,元素所在的周期数等于原子核外电子数 | |
| C. | 最外层电子数为8的微粒是稀有气体元素的原子 | |
| D. | 在元素周期表中,元素所在族的族序数等于原子核外最外层电子数 |
12.研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水”电池在海水中放电时的有关说法正确的是( )
| A. | 正极反应式:Ag+Cl--e-=AgCl | |
| B. | 每生成1 mol Na2Mn5O10转移2 mol电子 | |
| C. | Na+不断向“水”电池的负极移动 | |
| D. | AgCl是还原产物 |
2.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 2gD2中所含的电子的数目为2NA | |
| B. | 标况下4.48L CHCl3中所含的原子数目为NA | |
| C. | 4.4g CO2中所含的共用电子对数目为0.2NA | |
| D. | 14 g乙烯和环己烷(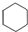 )的混合物中,所含碳原子数为NA )的混合物中,所含碳原子数为NA |
9.下列实验方案合理的是( )
| A. | 配制银氨溶液:在一定量2%的AgNO3溶液中滴加稀氨水至沉淀恰好溶解 | |
| B. | 除去混在苯中的少量苯酚:加入过量溴水,过滤 | |
| C. | 验证RX为碘代烷:把RX与烧碱水溶液混合加热,将溶液冷却后再加入硝酸银溶液 | |
| D. | 检验无水乙醇和浓硫酸共热后制得的气体是否为乙烯:将气体通入酸性KMnO4溶液 |
6.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,15g二氧化硅含有的分子数为0.25NA | |
| B. | 标准状况下,14g氮气含有的核外电子数为5NA | |
| C. | 标准状况下,22.4L任意比的氢气和氮气的混合气体中含有的分子总数均为2NA | |
| D. | 标准状况下,铝跟氢氧化钠溶液反应生成1 mol氢气时,转移的电子数为2NA |
7.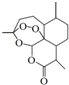 青蒿素是从植物黄花蒿茎叶中提取的有过氧基团的倍半萜内酯药物.其结构简式如图所示,则下列关于青蒿素的叙述正确的是( )
青蒿素是从植物黄花蒿茎叶中提取的有过氧基团的倍半萜内酯药物.其结构简式如图所示,则下列关于青蒿素的叙述正确的是( )
 青蒿素是从植物黄花蒿茎叶中提取的有过氧基团的倍半萜内酯药物.其结构简式如图所示,则下列关于青蒿素的叙述正确的是( )
青蒿素是从植物黄花蒿茎叶中提取的有过氧基团的倍半萜内酯药物.其结构简式如图所示,则下列关于青蒿素的叙述正确的是( )| A. | 青蒿素易溶于水,难溶于乙醇和丙酮等溶剂 | |
| B. | 青蒿素的分子式为:C15H20O5 | |
| C. | 青蒿素因其具有“-O-O-”,所以具有一定的氧化性 | |
| D. | 青蒿素可以与NaOH、Na2CO3、NaHCO3发生反应 |
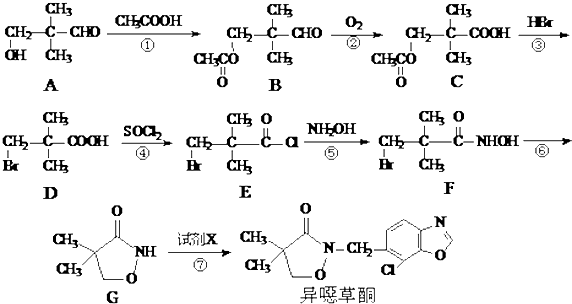
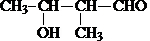
 .
. .
. 是B的一种重要的同分异构体.请设计合理方案,完成从
是B的一种重要的同分异构体.请设计合理方案,完成从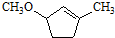 到
到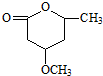 的合成路线(用合成路线流程图表示,并注明反应条件).
的合成路线(用合成路线流程图表示,并注明反应条件).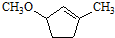 $→_{催化剂}^{H_{2}O}$…
$→_{催化剂}^{H_{2}O}$… ;
;