题目内容
下列反应的离子方程式有错误的是( )
| A、硫酸氢钠溶液与氢氧化钠溶液 H++OH-═H2O | ||
| B、钾与水K+2H2O=K++2OH-+H2↑ | ||
C、碳酸氢钙溶液与氢氧化钠溶液Ca2++HCO
| ||
D、小苏打溶液与盐酸反应HCO
|
考点:离子方程式的书写
专题:离子反应专题
分析:A.硫酸氢钠溶液与氢氧化钠溶液反应生成硫酸钠和水;
B.电荷不守恒;
C.碳酸氢钙溶液与少量氢氧化钠溶液反应生成碳酸钙、水和氢氧化钠;
D.小苏打溶液与盐酸反应生成二氧化碳、水和氯化钠.
B.电荷不守恒;
C.碳酸氢钙溶液与少量氢氧化钠溶液反应生成碳酸钙、水和氢氧化钠;
D.小苏打溶液与盐酸反应生成二氧化碳、水和氯化钠.
解答:
解:A.硫酸氢钠溶液与氢氧化钠溶液,离子方程式:H++OH-═H2O,故A正确;
B.钾与水,离子方程式:2K+2H2O=2K++2OH-+H2↑,故B错误;
C.碳酸氢钙溶液与少量氢氧化钠溶液反应,离子方程式为:Ca2++HCO3-+OH-=CaCO3↓+H2O,故C正确;
D.小苏打溶液与盐酸反应,离子方程式:HCO3-+H+=CO2↑+H2O,故D正确;
故选:B.
B.钾与水,离子方程式:2K+2H2O=2K++2OH-+H2↑,故B错误;
C.碳酸氢钙溶液与少量氢氧化钠溶液反应,离子方程式为:Ca2++HCO3-+OH-=CaCO3↓+H2O,故C正确;
D.小苏打溶液与盐酸反应,离子方程式:HCO3-+H+=CO2↑+H2O,故D正确;
故选:B.
点评:本题考查了离子方程式的书写,明确反应的实质是解题关键,书写时注意电荷守恒、原子个数守恒、化学式的拆分.

练习册系列答案
相关题目
在配制一定物质的量浓度的硫酸溶液时,下列错误操作可使所配制溶液浓度偏高的是( )
| A、浓硫酸稀释后马上转移至容量瓶 |
| B、溶解搅拌时有液体飞溅 |
| C、定容时仰视容量瓶瓶颈刻度线 |
| D、摇匀后见液面下降,再加水至刻度线 |
设NA为阿伏加德罗常数的值,下列说法正确是( )
| A、25℃时,pH=12的 Ba(OH)2溶液中含有的OH-数目为0.01 NA |
| B、9gH218O含有的中子数为5NA |
| C、常温常压下,28gC2H4、C3H6的混合气体中含有碳原子的数目为2NA |
| D、分子数为NA的CO、N2混合气体体积约为22.4L,质量为28g |
加入镁粉后会产生氢气的溶液中能大量共存的无色透明离子组是( )
| A、K+、Na+、NO3-、MnO4- |
| B、K+、Na十、Br-、CO32- |
| C、Mg2+、Na+、Cl-、SO42- |
| D、Na十、Ba2+、OH-、SO42- |
现在配制100mL 1mol/L NaOH溶液,下列操作正确的是( )
| A、在托盘天平的两个托盘上各放一张大小一样的纸,然后将氢氧化钠固体放在纸片上进行称量 |
| B、用蒸馏水洗涤烧杯、玻璃棒2-3次,每次洗涤后的溶液都注入容量瓶中 |
| C、把称量的NaOH固体放入盛有适量蒸馏水的烧杯中,溶解后立即把溶液移入100mL容量瓶中 |
| D、沿着玻璃棒往容量瓶中加入蒸馏水,直到溶液凹液面恰好与刻度相切 |
下列实验操作中正确的是( )
| A、滤去不溶性杂质以后,将滤液移至坩埚内加热浓缩 |
B、右图能用作防倒吸装置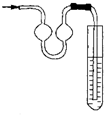 |
| C、蒸馏时,通过冷凝管冷凝得到的液体直接用锥形瓶接收 |
| D、称量NaOH固体时,应将砝码放在托盘天平右盘纸片上,NaOH固体放在左盘的纸片上 |
下列实验操作错误的是( )
A、 |
B、 |
C、 |
D、 |
将0.2mol/L的CH3COONa溶液与0.1mol/L的硝酸溶液等体积混合后,溶液中下列粒子的物质的量浓度的关系正确的是( )
| A、c(CH3COO-)+c (NO3-)+c (OH-)=c (H+)+c (Na+) |
| B、c(CH3COO-)=c (Na+)=c (NO3-)>c(CH3COOH)>c (H+) |
| C、c(CH3COO-)>c (NO3-)>c(CH3COOH)=c(Na+)>c(H+)>c (OH-) |
| D、c (Na+)>c(CH3COO-)>c (NO3-)>c(CH3COOH)>c (H+)>c(OH-) |