题目内容
下列实验操作中正确的是( )
| A、滤去不溶性杂质以后,将滤液移至坩埚内加热浓缩 |
B、右图能用作防倒吸装置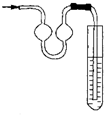 |
| C、蒸馏时,通过冷凝管冷凝得到的液体直接用锥形瓶接收 |
| D、称量NaOH固体时,应将砝码放在托盘天平右盘纸片上,NaOH固体放在左盘的纸片上 |
考点:物质的分离、提纯和除杂,计量仪器及使用方法
专题:实验评价题
分析:A.蒸发液体应用蒸发皿;
B.若发生倒吸,液体进入左侧大肚内;
C.冷凝管后连接牛角管;
D.氢氧化钠具有吸水性和腐蚀性.
B.若发生倒吸,液体进入左侧大肚内;
C.冷凝管后连接牛角管;
D.氢氧化钠具有吸水性和腐蚀性.
解答:
解:A.蒸发液体应用蒸发皿,坩埚用来灼烧固体,故A错误;
B.发生倒吸,液体进入左侧大肚内,又被压回右试管,故B正确;
C.冷凝管后连接牛角管,不能直接用锥形瓶接收,故C错误;
D.氢氧化钠具有吸水性和腐蚀性,应放在玻璃器皿中称量,故D错误.
故选B.
B.发生倒吸,液体进入左侧大肚内,又被压回右试管,故B正确;
C.冷凝管后连接牛角管,不能直接用锥形瓶接收,故C错误;
D.氢氧化钠具有吸水性和腐蚀性,应放在玻璃器皿中称量,故D错误.
故选B.
点评:本题考查化学实验的基本操作,题目难度不大,注意相关基本实验操作的实验注意事项.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案
相关题目
下表是常温下某些一元弱酸的电离常数:则0.1mol/L的下列溶液中,c(H+)最大的是( )
| 弱酸 | HCN | HF | CH3COOH | HNO2 |
| 电离常数 | 6.2×10-10 | 6.8×10-4 | 1.8×10-5 | 6.4×10-6 |
| A、HCN |
| B、HF |
| C、CH3COOH |
| D、HNO2 |
下列反应的离子方程式有错误的是( )
| A、硫酸氢钠溶液与氢氧化钠溶液 H++OH-═H2O | ||
| B、钾与水K+2H2O=K++2OH-+H2↑ | ||
C、碳酸氢钙溶液与氢氧化钠溶液Ca2++HCO
| ||
D、小苏打溶液与盐酸反应HCO
|
 短周期元素X、Y、Z在周期表中的位置如图所示,则下列说法正确的是( )
短周期元素X、Y、Z在周期表中的位置如图所示,则下列说法正确的是( )| A、X是活泼的非金属 |
| B、三种元素中Y的非金属性最强 |
| C、Z的最高价氧化物的水化物是强酸 |
| D、Y的最高价氧化物的水化物是一种强酸 |
在一定温度下,体积不变的密闭容器中发生如下反应:CO2+H2?CO+H2O.已知在此条件下,3molCO2和1molH2充分反应达到平衡时,H2的转化率为75%.若在此条件下加入4molCO2和1molH2,则达到平衡时CO和H2O的物质的量之和为( )
| A、1.5mol |
| B、1.6mol |
| C、1.8mol |
| D、2.5mol |
设NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A、将2mol NO和1molO2混合后,体系中的原子总数为6NA |
| B、0.01mol Mg在CO2中完全燃烧,转移电子数为0.01NA |
| C、标准状况下,3.2gCu与足量的浓硝酸反应生成气体的分子数为0.2NA |
| D、7.8Na2O2含有的阴离子数为0.2NA |
在25℃、101kPa下,0.1mol甲醇燃烧生成CO2和液态水时放热72.58kJ,下列热化学方程式正确的是( )
A、CH3OH(l)+
| ||
| B、2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l);△H=-725.8 kJ?mol-1 | ||
C、CH3OH(l)+
| ||
| D、2CH3OH(l)+3O2(g)=2 CO2(g)+4H2O(g);△H=-1451.6 kJ?mol-1 |