题目内容
在学了盐的性质以后,某校化学兴趣小组的同学开展了测定Na2CO3和NaCl的固体混合物中Na2CO3质量分数的探究实验.他们设计了如下的实验方案:
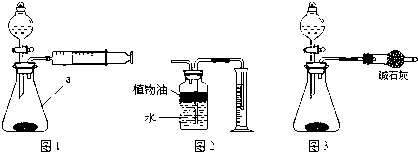
[方案一]气体分析法.
(1)如图1所示,把混合物与足量稀盐酸反应后,测定产生的CO2气体的体积.检查该装置的气密性时,某同学将注射器活塞拉出一定距离,松开活塞,活塞回到原位.则说明该装置的气密性 ,几次试验发现结果都偏高你认为主要原因 .
(2)有同学以图2的收集装置,其中在水面上放一层植物油的目的是 ,植物油上方原有空气对实验结果 (填“有”或“没有”)影响.读数时发现量筒液面高于集气瓶中液面应如何操作 .
(3)也有人用图3装置测定CO2的质量 (碱石灰的成分是CaO和NaOH的混合物,可吸收CO2气体).该装置导致实验结果偏小的可能原因是
A、装置内残留的CO2气体不能全部排出.
B、产生的CO2气体中混有氯化氢气体,同时被碱石灰吸收.
C、产生的CO2气体中混有水蒸气,同时被碱石灰吸收.
D、球形干燥管与空气相通,也会吸收空气中的CO2和H2O.
[方案二]沉淀分析法 (如图所示).
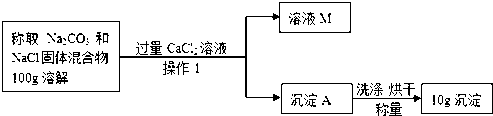
则:(1)确定CaCl2溶液是否过量的方法是 ;
(2)写出Na2CO3的质量分数为 ;
(3)若沉淀A没有洗涤烘干,导致Na2CO3的质量分数 (填“偏大”或“偏小”).

[方案一]气体分析法.
(1)如图1所示,把混合物与足量稀盐酸反应后,测定产生的CO2气体的体积.检查该装置的气密性时,某同学将注射器活塞拉出一定距离,松开活塞,活塞回到原位.则说明该装置的气密性
(2)有同学以图2的收集装置,其中在水面上放一层植物油的目的是
(3)也有人用图3装置测定CO2的质量 (碱石灰的成分是CaO和NaOH的混合物,可吸收CO2气体).该装置导致实验结果偏小的可能原因是
A、装置内残留的CO2气体不能全部排出.
B、产生的CO2气体中混有氯化氢气体,同时被碱石灰吸收.
C、产生的CO2气体中混有水蒸气,同时被碱石灰吸收.
D、球形干燥管与空气相通,也会吸收空气中的CO2和H2O.
[方案二]沉淀分析法 (如图所示).

则:(1)确定CaCl2溶液是否过量的方法是
(2)写出Na2CO3的质量分数为
(3)若沉淀A没有洗涤烘干,导致Na2CO3的质量分数
考点:探究物质的组成或测量物质的含量,钠的重要化合物
专题:实验探究和数据处理题
分析:【方案一】(1)如果装置不漏气向后拉注射器活塞,在外界大气压的作用下,松开后注射器应回到原位进行解答;滴下的稀盐酸的体积会排出部分空气;
(2)二氧化碳易溶于水,在水面涂一层植物油,使二氧化碳不能溶于水;植物油上方空气不溶于水,对实验结果无影响;读数时应使两端液面相平,保证压强相等;
(2)A、反应完成后,装置中仍存有二氧化碳,没有被碱石灰吸收,生成的二氧化碳不能全部吸收结果偏低;
B、产生的CO2气体中混有氯化氢气体,同时被碱石灰吸收,导致结果偏高;
C、产生的CO2气体中混有水蒸气,同时被碱石灰吸收,导致结果偏高;
D、球形干燥管与空气相通,也会吸收空气中的CO2和H2O,导致结果偏高;
【方案二】碳酸钠和氯化钙生成碳酸钙沉淀,通过沉淀的质量来计算碳酸钠的质量,进而计算质量分数.
(1)若CaCl2不过量,则会有Na2CO3剩余,再加入CaCl2后若生成沉淀则说明不过量,如果无沉淀,则过量;
(2)根据碳酸钠和氯化钙反应的化学方程式结合生成的碳酸钙的质量列比例方程计算即可;
(3)若沉淀A没有洗涤烘干,会导致计算出的碳酸钠质量偏大.
(2)二氧化碳易溶于水,在水面涂一层植物油,使二氧化碳不能溶于水;植物油上方空气不溶于水,对实验结果无影响;读数时应使两端液面相平,保证压强相等;
(2)A、反应完成后,装置中仍存有二氧化碳,没有被碱石灰吸收,生成的二氧化碳不能全部吸收结果偏低;
B、产生的CO2气体中混有氯化氢气体,同时被碱石灰吸收,导致结果偏高;
C、产生的CO2气体中混有水蒸气,同时被碱石灰吸收,导致结果偏高;
D、球形干燥管与空气相通,也会吸收空气中的CO2和H2O,导致结果偏高;
【方案二】碳酸钠和氯化钙生成碳酸钙沉淀,通过沉淀的质量来计算碳酸钠的质量,进而计算质量分数.
(1)若CaCl2不过量,则会有Na2CO3剩余,再加入CaCl2后若生成沉淀则说明不过量,如果无沉淀,则过量;
(2)根据碳酸钠和氯化钙反应的化学方程式结合生成的碳酸钙的质量列比例方程计算即可;
(3)若沉淀A没有洗涤烘干,会导致计算出的碳酸钠质量偏大.
解答:
解:【方案一】(1)将注射器活塞拉出一定距离,松开活塞,活塞回到原位.则说明该装置的气密性好,滴下的稀盐酸的体积会排出部分空气,导致所测气体体积增大,故答案为:好;滴下的稀盐酸的体积使所测气体体积增大;
(2)二氧化碳易溶于水,在水面涂一层植物油,使二氧化碳不能溶于水;植物油上方空气不溶于水,对实验结果无影响;读数时应使两端液面相平,保证压强相等,向下移动量筒,使量筒内液面与集气瓶内液面相平,
故答案为:防止二氧化碳溶于水;没有;向下移动量筒,使量筒内液面与集气瓶内液面相平;
(3)A、反应完成后,装置中仍存有二氧化碳,没有被碱石灰吸收,生成的二氧化碳不能全部吸收结果偏低,故A符合;
B、产生的CO2气体中混有氯化氢气体,同时被碱石灰吸收,导致结果偏高,故B不符合;
C、产生的CO2气体中混有水蒸气,同时被碱石灰吸收,导致结果偏高,故C不符合;
D、球形干燥管与空气相通,也会吸收空气中的CO2和H2O,导致结果偏高,故D不符合;
故答案为:A;
【方案二】
(1)若CaCl2不过量,则会有Na2CO3剩余,再加入CaCl2后若生成沉淀则说明不过量,如果无沉淀,则过量,
故答案为:静置分层往上层清液中继续滴加氯化钙若无沉淀则过量;
(2)设样品中Na2CO3的质量分数为x,则
Na2CO3+CaCl2=2NaCl+CaCO3↓
106 100
100gx 10g
x=
=0.106=10.6%,故答案为:10.6%;
(3)若沉淀A没有洗涤烘干,会导致计算出的碳酸钠质量偏大,碳酸钠的质量分数就偏大;故答案为:偏大.
(2)二氧化碳易溶于水,在水面涂一层植物油,使二氧化碳不能溶于水;植物油上方空气不溶于水,对实验结果无影响;读数时应使两端液面相平,保证压强相等,向下移动量筒,使量筒内液面与集气瓶内液面相平,
故答案为:防止二氧化碳溶于水;没有;向下移动量筒,使量筒内液面与集气瓶内液面相平;
(3)A、反应完成后,装置中仍存有二氧化碳,没有被碱石灰吸收,生成的二氧化碳不能全部吸收结果偏低,故A符合;
B、产生的CO2气体中混有氯化氢气体,同时被碱石灰吸收,导致结果偏高,故B不符合;
C、产生的CO2气体中混有水蒸气,同时被碱石灰吸收,导致结果偏高,故C不符合;
D、球形干燥管与空气相通,也会吸收空气中的CO2和H2O,导致结果偏高,故D不符合;
故答案为:A;
【方案二】
(1)若CaCl2不过量,则会有Na2CO3剩余,再加入CaCl2后若生成沉淀则说明不过量,如果无沉淀,则过量,
故答案为:静置分层往上层清液中继续滴加氯化钙若无沉淀则过量;
(2)设样品中Na2CO3的质量分数为x,则
Na2CO3+CaCl2=2NaCl+CaCO3↓
106 100
100gx 10g
x=
| 106×10g |
| 100×100g |
(3)若沉淀A没有洗涤烘干,会导致计算出的碳酸钠质量偏大,碳酸钠的质量分数就偏大;故答案为:偏大.
点评:本题考查了混合物组成成分测定,中等难度,注意理解实验原理,结合物质的性质进行分析、计算.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、46g NO2气体中含有的分子数一定为NA |
| B、1molCH3+(碳正离子)中含有电子数为10NA |
| C、1mol铜与足量硫蒸气反应,转移电子数为2NA |
| D、1mol Mg与足量O2或N2反应生成MgO或Mg3N2,均失去2NA个电子 |
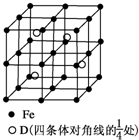 A、B、C、D分别代表四种不同的短周期元素.A、B元素原子的价电子排布分别为ns1、ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p亚层中有1个电子.
A、B、C、D分别代表四种不同的短周期元素.A、B元素原子的价电子排布分别为ns1、ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p亚层中有1个电子.