题目内容
已知x、y、z、w为短周期主族元素,原子序数依次增大,已知x+与Ne原子具有相同的电子层结构,z原子的m层电子数是k层电子数的三倍,x、y、z三种元素的最高价对应的水化物两两之间能够发生反应.
(1)比较z、w两元素最高价氧化物对应的水化物的酸性.
(2)写出x、y两元素最高价氧化物对应的水化物发生反应的离子方程式.
(1)比较z、w两元素最高价氧化物对应的水化物的酸性.
(2)写出x、y两元素最高价氧化物对应的水化物发生反应的离子方程式.
考点:原子结构与元素的性质
专题:元素周期律与元素周期表专题
分析:已知x、y、z、w为短周期主族元素,原子序数依次增大,已知x+与Ne原子具有相同的电子层结构,则x含有11个电子,为Na元素,z原子的m层电子数是k层电子数的三倍,则z为S元素,x、y、z三种元素的最高价对应的水化物两两之间能够发生反应,则y的最高价对应的水化物有两性,则y为Al元素,w的原子序数大于z,而且为短周期,则w为Cl元素,据此分析.
解答:
解:已知x、y、z、w为短周期主族元素,原子序数依次增大,已知x+与Ne原子具有相同的电子层结构,则x含有11个电子,为Na元素,z原子的m层电子数是k层电子数的三倍,则z为S元素,x、y、z三种元素的最高价对应的水化物两两之间能够发生反应,则y的最高价对应的水化物有两性,则y为Al元素,w的原子序数大于z,而且为短周期,则w为Cl元素,
(1)元素的非金属性越强,则最高价氧化物对应的水化物的酸性越强,非金属性:S<Cl,则酸性:H2SO4<HClO4;
答:z、w两元素最高价氧化物对应的水化物的酸性:H2SO4<HClO4;
(2)x为Na,y为Al,则两元素最高价氧化物对应的水化物的反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O;
答:x、y两元素最高价氧化物对应的水化物发生反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O.
(1)元素的非金属性越强,则最高价氧化物对应的水化物的酸性越强,非金属性:S<Cl,则酸性:H2SO4<HClO4;
答:z、w两元素最高价氧化物对应的水化物的酸性:H2SO4<HClO4;
(2)x为Na,y为Al,则两元素最高价氧化物对应的水化物的反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O;
答:x、y两元素最高价氧化物对应的水化物发生反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O.
点评:本题考查原子结构和元素周期律,熟练掌握原子的电子排布规律是解题的关键,知道非金属的非金属性与最高价氧化物的水化物酸性强弱关系,题目难度不大.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
下列说法正确的是( )
| A、还原剂失去电子变成还原产物 |
| B、氧化剂被氧化成还原产物 |
| C、氧化剂是得到电子,发生还原反应的物质 |
| D、还原剂是化合价下降得到电子被氧化的物质 |
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、46g NO2气体中含有的分子数一定为NA |
| B、1molCH3+(碳正离子)中含有电子数为10NA |
| C、1mol铜与足量硫蒸气反应,转移电子数为2NA |
| D、1mol Mg与足量O2或N2反应生成MgO或Mg3N2,均失去2NA个电子 |
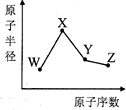 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子数变化如图所示.已知W的一种核素的质量数为18,中子数为10,X和Ne原子的核外电子数相差1,Y的单质是一种常见的半导体材料,Z的非金属性在同周期元素中最强.下列说法正确的是( )
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子数变化如图所示.已知W的一种核素的质量数为18,中子数为10,X和Ne原子的核外电子数相差1,Y的单质是一种常见的半导体材料,Z的非金属性在同周期元素中最强.下列说法正确的是( )| A、对应简单离子半径:X>W |
| B、对应气态氢化物的稳定性Y>Z |
| C、化合物XZW既含离子键,又含共价键 |
| D、Y的氧化物与Z的氧化物和X的最高价氧化物对应的水化物均能反应 |
下列物质的分类正确的一组是( )
| A、单质:水银、石墨、氦气、HD |
| B、氧化物:金刚砂、Na2O2、双氧水、N2O4 |
| C、混合物:水玻璃、盐酸、胆矾、AgI胶体 |
| D、盐:碱式碳酸铜、小苏打、KI,Ba(OH)2 |