题目内容
10.关于溶液、浊液、胶体说法正确的是( )| A. | 均能产生丁达尔现象 | B. | 都是混合物 | ||
| C. | 分散质均能透过半透膜 | D. | 分散质均能通过滤纸 |
分析 A.胶体能产生丁达尔现象;
B.这三种分散系都是混合物;
C.浊液和胶体不能透过半透膜;
D.浊液不能通过滤纸.
解答 解:A.胶体能产生丁达尔现象,溶液和浊液不能产生,故A错误;
B.溶液、浊液、胶体都是混合物,故B正确;
C.浊液和胶体不能透过半透膜,溶液可以透过,故C错误;
D.浊液不能通过滤纸,溶液和胶体可以透过,故D;
故选B.
点评 本题考查溶液、浊液、胶体的区别与联系,难度不大,注意三种分散系的本质区别是分散质粒子直径的大小不同,不是丁达尔效应.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案
相关题目
18.下列关于元素原子或离子半径的比较.正确的是( )
| A. | r(Al)>r(Si)>r(C)>r(N) | B. | r(Na+)<r(Mg2+)<r(Al3+)<r(F-) | ||
| C. | r(K+)>r(Ca2+)>r(S2-)>r(Cl-) | D. | r(N)<r(S)<r(O)<r(P) |
1.如图是工业上生产碳酸锂的部分工艺流程,请根据流程图及已知信息回答问题.

已知:①锂辉石主要万分为Li2O•Al2O3•4SiO2,含有少量Ca、Mg元素.
②Li2O•Al2O3•4SiO2+H2SO4(浓)$\frac{\underline{\;250-300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O↓
③几种物质不同温度下的溶解度.
(1)从滤渣1中分离出Al2O3的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质.写出图中①、②、③表示的各物质,步骤II中反应的离子方程式是Al3++3NH3•H2O=Al(OH)3↓+3NH4+.

(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3,写出生成滤渣2反应的离子方程式:Mg2++2OH-=Mg(OH)2↓,Ca2++CO32-=CaCO3↓.
(3)向滤液2中加入饱和Na2CO,溶液,过滤后,用“热水洗涤”的原因是Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失.
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下.
①将粗产品Li2CO3溶于盐酸作用解槽的阳极液,LiOH溶液作阴极液,两者用离子选择半透膜隔开,用惰性电极电解.阳极的电极反应式是2C1--2e-=Cl2↑.
②电解后向产品LiOH溶液中加入过量NH4HCO,溶液生成Li2CO3反应的化学方程式是2LiOH+2NH4HCO3=Li2CO3+(NH4)2CO3+2H2O.

已知:①锂辉石主要万分为Li2O•Al2O3•4SiO2,含有少量Ca、Mg元素.
②Li2O•Al2O3•4SiO2+H2SO4(浓)$\frac{\underline{\;250-300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O↓
③几种物质不同温度下的溶解度.
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |

(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3,写出生成滤渣2反应的离子方程式:Mg2++2OH-=Mg(OH)2↓,Ca2++CO32-=CaCO3↓.
(3)向滤液2中加入饱和Na2CO,溶液,过滤后,用“热水洗涤”的原因是Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失.
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下.
①将粗产品Li2CO3溶于盐酸作用解槽的阳极液,LiOH溶液作阴极液,两者用离子选择半透膜隔开,用惰性电极电解.阳极的电极反应式是2C1--2e-=Cl2↑.
②电解后向产品LiOH溶液中加入过量NH4HCO,溶液生成Li2CO3反应的化学方程式是2LiOH+2NH4HCO3=Li2CO3+(NH4)2CO3+2H2O.
18.下列各式中,属于正确的电离方程式的是( )
| A. | HCO3-+H+?H2CO3 | B. | HCO3-+OH-═H2O+CO32- | ||
| C. | NH3+H+═NH4+ | D. | NH3•H2O?NH4++OH- |
5.下列各组有机物不是同分异构体的是( )
| A. | CH3CH2CH2OH和CH3-O-CH2CH3 | B. |  | ||
| C. |  和CH3(CH2)2CHO 和CH3(CH2)2CHO | D. |  |
15.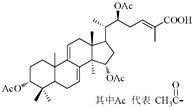 某高校研究课题组利用生物发酵技术生产灵芝酸单体的分子结构图如图所示,下列关于该有机物的说法不正确的是( )
某高校研究课题组利用生物发酵技术生产灵芝酸单体的分子结构图如图所示,下列关于该有机物的说法不正确的是( )
 某高校研究课题组利用生物发酵技术生产灵芝酸单体的分子结构图如图所示,下列关于该有机物的说法不正确的是( )
某高校研究课题组利用生物发酵技术生产灵芝酸单体的分子结构图如图所示,下列关于该有机物的说法不正确的是( )| A. | 能与Br2发生加成反应 | B. | 能发生酯化反应 | ||
| C. | 能发生水解反应 | D. | 分子中有7个手性碳原子 |
19.直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:2SO2+O2+2H2O=2H2SO4.
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是SO2+2OH-=SO32-+H2O.
(3)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
①由表判断,NaHSO3溶液显酸性,用化学平衡原理解释:HSO3-存在:HSO3-?SO32-+H+和HSO3-+H2O?H2SO3+OH-,HSO3-的电离程度大于水解程度.
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):ab.
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(4)(2012•福建高考节选)能证明Na2SO3溶液中存在SO32-+H2O?HSO3-+OH-水解平衡的事实是C(填序号).
A.滴入酚酞溶液变红,再加入H2SO4溶液后红色褪去
B.滴入酚酞溶液变红,再加入氯水后红色褪去
C.滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去.
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:2SO2+O2+2H2O=2H2SO4.
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是SO2+2OH-=SO32-+H2O.
(3)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):ab.
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(4)(2012•福建高考节选)能证明Na2SO3溶液中存在SO32-+H2O?HSO3-+OH-水解平衡的事实是C(填序号).
A.滴入酚酞溶液变红,再加入H2SO4溶液后红色褪去
B.滴入酚酞溶液变红,再加入氯水后红色褪去
C.滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去.
20.下列说法中正确的一组是( )
| A. | H2和D2互为同位素 | B. |  和 和 互为同分异构体 互为同分异构体 | ||
| C. | 正丁烷和异丁烷是互为同分异构体 | D. | 四氯化碳的电子式 |