题目内容
7.乙炔是有机合成工业的一种原料.工业上曾用CaC2与水反应生成乙炔(C2H2).(1)CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为
 ;1mol O22+中含有的π键数目为2NA.
;1mol O22+中含有的π键数目为2NA.(2)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N).丙烯腈分子中碳原子轨道杂化类型是sp2、sp;分子中处于同一直线上的原子数目最多为3.
分析 (1)根据等电子体的结构相似,故O22+的电子式与C22-的电子式相似;根据三键中有2个π键来计算;
(2)丙烯腈(H2C=CH-C≡N)中的C分别形成2个δ键和3个δ键,C=C为平面结构,C≡N为直线结构,以此解答.
解答 解:(1)根据等电子体原理可知,O22+的电子式  ,在1个O22+含有2个π键,故1 mol O22+中,含有2NA个π键,
,在1个O22+含有2个π键,故1 mol O22+中,含有2NA个π键,
故答案为: ;2NA;
;2NA;
(2)丙烯腈分子中碳原子有2种,C=C中C的σ键数为3,C为sp2杂化,C≡N为直线结构,C≡N中σ键数为2,则C为sp杂化,分子中处于同一直线上的原子数为与C≡N直接相连的C,共3个原子,
故答案为:sp2、sp;3.
点评 本题考查较综合,侧重物质结构与性质的考查,涉及等电子体、化学键及杂化类型等,为高频考点,题目难度中等,注意(2)中利用空间构型分析杂化类型.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
17.人们对原子结构的认识有一个不断深入的过程,下列先后顺序中符合史实的是( )
①道尔顿提出的原子论②卢瑟福的原子结构行星模型③玻尔提出的原子力学模型④汤姆孙提出的葡萄干面包原子模型.
①道尔顿提出的原子论②卢瑟福的原子结构行星模型③玻尔提出的原子力学模型④汤姆孙提出的葡萄干面包原子模型.
| A. | ①②③④ | B. | ①③②④ | C. | ②①④③ | D. | ①④②③ |
18.下列实验中,所选装置不合理的是( )
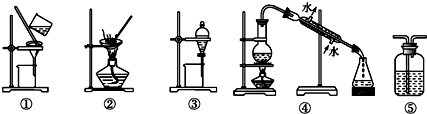

| A. | 用FeCl2溶液吸收Cl2,选⑤ | B. | 分离Na2CO3溶液和油脂,选④ | ||
| C. | 用四氯化碳提取碘水中的碘,选③ | D. | 粗盐提纯,选①和② |
19. 某兴趣小组用如图装置制备气体(酒精灯可以根据需要选择),对应说法正确的是( )
某兴趣小组用如图装置制备气体(酒精灯可以根据需要选择),对应说法正确的是( )
 某兴趣小组用如图装置制备气体(酒精灯可以根据需要选择),对应说法正确的是( )
某兴趣小组用如图装置制备气体(酒精灯可以根据需要选择),对应说法正确的是( )| 选项 | ①药品 | ②中药品 | ③中药品 | ④中药品 | 制备气体 | ⑥中药品及作用 |
| A | 浓盐酸 | MnO2 | 饱和食盐水 | 浓硫酸 | Cl2 | NaOH溶液,尾气吸收 |
| B | 稀硝酸 | Cu | 烧碱溶液 | 浓硫酸 | NO | NaOH溶液,尾气吸收 |
| C | 浓盐酸 | 大理石 | 饱和Na2CO3溶液 | 浓硫酸 | CO2 | 澄清石灰水,检验 |
| D | 浓盐酸 | Zn | 水 | 浓硫酸 | H2 | 撤去 |
| A. | A | B. | B | C. | C | D. | D |
16.下列性质中,不能说明乙酸是弱电解质的是( )
①醋酸钠溶液的pH 大于7
②常温时,0.1mol/L乙酸溶液的pH约为3
③乙酸能和碳酸钙反应放出CO2
④10mL 1mol/L乙酸溶液与10mL 1mol/L的NaOH溶液恰好完全反应
⑤同pH的盐酸和乙酸分别与足量铁片反应,乙酸产生H2多
⑥pH=1的醋酸溶液用水稀释1000倍后,pH<4.
①醋酸钠溶液的pH 大于7
②常温时,0.1mol/L乙酸溶液的pH约为3
③乙酸能和碳酸钙反应放出CO2
④10mL 1mol/L乙酸溶液与10mL 1mol/L的NaOH溶液恰好完全反应
⑤同pH的盐酸和乙酸分别与足量铁片反应,乙酸产生H2多
⑥pH=1的醋酸溶液用水稀释1000倍后,pH<4.
| A. | ①②③ | B. | ④⑤⑥ | C. | ②③④ | D. | ③④⑤ |
17.下列各组中的两组物质互为同系物的是( )
| A. | 乙苯与二甲苯 | B. | 乙醇与乙二醇 | C. | 乙烯与聚乙烯 | D. | 甲烷与新戊烷 |