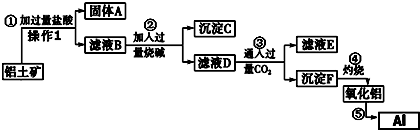
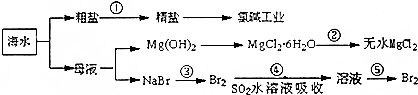
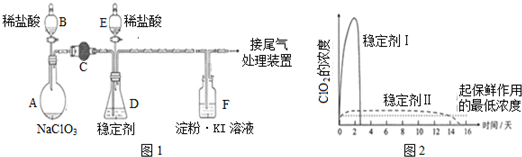
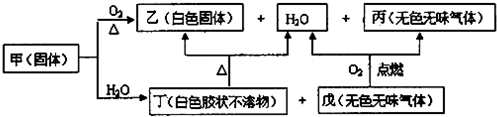
题目内容
3.以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如图,下列说法不正确的是( )
| A. | 阴极发生的电极反应为:2H++2e-=H2↑ | |
| B. | 在阳极室,通电后溶液逐渐由橙色变为黄色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+?Cr2O72-+H2O向右移动 | |
| C. | 该制备过程总反应的化学方程式为:4K2CrO4+4H2O$\frac{\underline{\;通电\;}}{\;}$2K2Cr2O7+4KOH+2H2↑+O2↑ | |
| D. | 测定阳极液中K和Cr的含量,若K与Cr的物质的量之比为d,则铬酸钾的转化率为2-d |
分析 A、阴极上得电子发生还原反应,氢离子放电;
B、阳极上水失电子生成氧气和氢离子,氢离子浓度增大导致平衡移动,根据氢离子浓度的变化判断溶液颜色的变化;
C、将阳极室、阴极室发生的反应加合可得总的反应式,注意阴极室还发生反应2CrO42-+2H+═Cr2O72-+H2O;
D、根据原子守恒计算其转化率.
解答 解:A、电极均为惰性电极,在阴极室发生还原反应,水得电子变成氢气,电极反应为:2H++2e-=H2↑,故A正确;
B、阳极室发生氧化反应,水失去电子放电,电极反应为:2H2O-4e-=4H++O2↑,阳极区氢离子浓度增大,平衡右移,溶液逐渐由黄色变为橙色,故B错误;
C、阴极电极反应为:4H2O+4e-=4OH-+2H2↑,阳极反应为:2H2O-4e-=4H++O2↑,4CrO42-+4H+═2Cr2O72-+2H2O,故总制备方程式为4K2CrO4 +4H2O $\frac{\underline{\;通电\;}}{\;}$2K2Cr2O7 +4KOH+2H2↑+O2↑,故C正确;
D、设加入反应容器内的K2CrO4为1mol,反应过程中有xmol K2CrO4转化为K2Cr2O7,则阳极区剩余K2CrO4为(1-x)mol,对应的n(K)=2(1-x)mol,n(Cr)=(1-x)mol,生成的K2Cr2O7为$\frac{x}{2}$mol,对应的n(K)=xmol,n(Cr)=xmol,根据:K与Cr的物质的量之比为d,$\frac{2(1-x)+x}{1-x+x}$=d,解得x=2-d,转化率为$\frac{2-d}{1}$×100%=2-d,故D正确;
故选B.
点评 本题考查了电解原理,难点是计算转化率,根据原子守恒即可计算其转化率,根据阴阳极上发生的反应类型写出相应的电极反应式.

 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案| A. | 都比较稳定,久置不变浑浊 | B. | 相同的颜色 | ||
| C. | 有丁达尔现象 | D. | 加盐酸先产生沉淀,后沉淀溶解 |
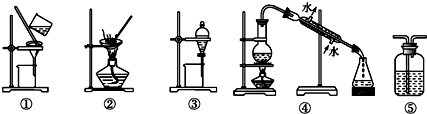
| A. | 用FeCl2溶液吸收Cl2,选⑤ | B. | 分离Na2CO3溶液和油脂,选④ | ||
| C. | 用四氯化碳提取碘水中的碘,选③ | D. | 粗盐提纯,选①和② |
| A. | 2L0.5mol/L亚硫酸钠溶液中含有的H+离子数为2NA | |
| B. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |