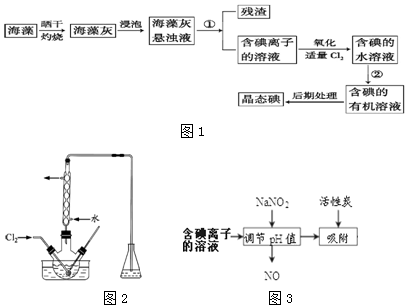
题目内容
7. 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.(1)一定温度下,在2L的密闭容器中,SO2、O2、SO3三种气体的物质的量随时间变化的曲线如图所示,请回答下列问题:
①反应的化学方程式为2SO2+O2 $\frac{\underline{催化剂}}{△}$2SO3
②反应开始到10s,用SO2表示的反应速率为0.08mol/(L•s)
③O2的平衡转化率为80%
(2)对于反应:2SO2(g)+O2(g)?2SO3(g),当反应达到平衡时,如果反应速率υ(SO2)为0.05mol•L-1•min-1,则υ(O2)=0.025mol•L-1•min-1;υ(SO3)=0.05mol•L-1•min-1.
(3)已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1
2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ•mol-1
则反应NO2(g)+SO2(g)?SO3(g)+NO(g)的△H=-41.8 kJ•mol-1.
(4)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是bd
a、体系压强保持不变 b、混合气体颜色保持不变
c、SO3和NO的体积比保持不变 d、每消耗1mol SO3的同时生成1mol NO.
分析 (1)①由图象可以看出,有SO2:O2:SO3=(2.00mol-0.4mol):(1.0mol-0.2mol):1.6mol=2:1:2,化学反应中各物质的物质的量变化量与化学计量数之比呈正比,据此书写化学方程式;
②反应速率v=$\frac{△c}{△t}$;
③氧气转化率=$\frac{消耗量}{起始量}$×100%;
(2)化学反应中反应速率之比等于化学方程式计量数之比;
(3)①2SO2(g)+O2═2SO3(g)△H=-196.6kJ•mol-1,
②2NO(g)+O2═2NO2(g)△H=-113.0kJ•mol-1.
根据盖斯定律可知:将$\frac{①-②}{2}$计算;
(4)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:(1)①化学反应中各物质的物质的量变化量与化学计量数之比呈正比,由图象可以看出,有SO2:O2:SO3=(2.00mol-0.4mol):(1.0mol-0.2mol):1.6mol=2:1:2,
则反应的化学方程式为:2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3,
故答案为:2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3;
②ν(SO2)=$\frac{\frac{2.00mol-0.4mol}{2L}}{10s}$=0.08mol/(L•s),
故答案为:0.08mol/(L•s);
③O2的平衡转化率=$\frac{1.0mol-0.2mol}{1.0mol}$×100%=80%,
故答案为:80%;
(2)对于反应:2SO2(g)+O2(g)?2SO3(g),当反应达到平衡时,如果反应速率υ(SO2)为0.05mol•L-1•min-1,则υ(O2)=$\frac{1}{2}$υ(SO2)=0.025 mol•L-1•min-1;
υ(SO3)=υ(SO2)=0.05 mol•L-1•min-1,
故答案为:0.025 mol•L-1•min-1;0.05 mol•L-1•min-1;
(3)已知:①2SO2(g)+O2═2SO3(g)△H=-196.6kJ•mol-1,
②2NO(g)+O2═2NO2(g)△H=-113.0kJ•mol-1.
根据盖斯定律可知:将$\frac{①-②}{2}$可得:NO2(g)+SO2(g)═SO3(g)+NO(g)△H=$\frac{-196.6+113}{2}$=-41.8 kJ•mol-1,
故答案为:-41.8;
(4)A、反应前后气体两边的计量数相等,所以体系压强始终不变,故A错误;
B、混合气体颜色保持不变,则二氧化氮的浓度不变,正逆反应速率相等,说明达平衡状态,故B正确;
C、三氧化硫和一氧化氮的体积比始终是1:1,无法判断是否达到了平衡状态,故C错误;
D、每消耗1mol SO3的同时生成1mol NO,说明正逆反应速率相同,反应达到平衡状态,故D正确;
故答案为:bd.
点评 本题考查物质的量随时间的变化曲线、以及化学平衡的计算、盖斯定律的应用和学生的运算能力,侧重于学生的分析能力和计算能力的考查,题目难度中等,注意把握化学方程式的判断方法.

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案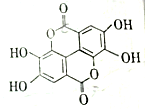 二缩双是一种广泛存在于各种软果、坚果等植物组织中的天然组分,其结构简式如图,二缩双在稀硫酸作用下水解不能得到的产物的类别是( )
二缩双是一种广泛存在于各种软果、坚果等植物组织中的天然组分,其结构简式如图,二缩双在稀硫酸作用下水解不能得到的产物的类别是( )| A. | 酚 | B. | 醛 | C. | 芳香族化合物 | D. | 羧酸 |
| A. | 80mL10mol/L的浓盐酸与足量MnO2反应,转移电子数为0.4 NA | |
| B. | 标准状况下,22.4LNO和11.2L氧气混合,气体的分子总数为1.5 NA | |
| C. | 7.2 g CaO2晶体中阴离子和阳离子总数为0.3 NA | |
| D. | 将1 mol NH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA |
已知101kPa、25℃时,1mol下列物质完全燃烧生成稳定状态化合物时放出的热量数据如表:
| 物质 | 氢气 | 原煤 (主要成份是C) | 汽油 (主要成份C8H18) |
| 热量(kJ) | 285.8 | 250.9 | 4910 |
(2)工业上电解饱和盐水的副产物之一是H2,反应的离子方程式是2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑.
Na2CO3溶液$\stackrel{甲}{→}$白色沉淀$\stackrel{过量乙}{→}$沉淀完全溶解并产生气体$\stackrel{丙}{→}$产生白色沉淀
则甲、乙、丙三种溶液可能是( )
| A. | BaCl2、H2SO4、MgCl2 | B. | NaCl、HNO3、AgNO3 | ||
| C. | CaCl2、HNO3、NaCl | D. | BaCl2、HCl、Na2SO4 |
| A. | NH3 | B. | 蔗糖 | C. | 空气 | D. | 液态HC1 |