题目内容
11.请回答下列问题:(1)火箭燃料液态偏二甲肼(C2H8N2)是用液态N2O4作氧化剂,二者反应放出大量的热,生成无毒、无污染的气体和水.已知室温下,1g燃料完全燃烧释放出的能量为42.5kJ,则该反应的热化学方程式为C2H8N2(l)+2N2O4(l)=2CO2(g)+3N2(g)+4H2O(l)△H=-2550 kJ•mol-1.
(2)298K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g)?N2O4(g)△H=-a kJ•mol-1 (a>0).N2O4的物质的量浓度随时间变化如图1.达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
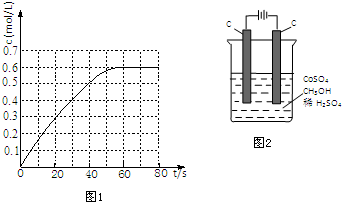
①298k时,该反应的平衡常数为6.67L•mol-1(精确到0.01).
②下列情况不是处于平衡状态的是a:
a.混合气体的密度保持不变;b.混合气体的颜色不再变化; c.气压恒定时.
③若反应在398K进行,某时刻测得n(NO2)=0.6mol n(N2O4)=1.2mol,则此时V(正)<V(逆)(填“>”、“<”或“=”).
(3)工业上“除钙、镁”的原理反应为:MgSO4+2NaF═MgF2↓+Na2SO4;CaSO4+2NaF═CaF2↓+Na2SO4
已知KSP(CaF2)=1.11×10-10,KSP(MgF2)=7.40×10-11,加入过量NaF溶液反应完全后过滤,则滤液中 $\frac{c(C{a}^{2+})}{c(M{g}^{2+})}$=1.5.
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+).现用图2装置模拟上述过程,则:Co2+在阳极的电极反应式为:Co2+-e-=Co3+;
除去甲醇的离子方程式为6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.
分析 (1)先求出偏二甲肼的物质的量,再根据物质的量之比等于热量比求出反应热,然后写出热化学方程式;
(2)①有图可知N2O4的平衡浓度为0.6mol/L,达到平衡时,N2O4的浓度为NO2的2倍,则NO2的平衡浓度为0.3mol/L,带入平衡常数表达式计算;
②a、气体的质量不变,容积恒定,因此气体的密度为一定值;
b、混合气体的颜色不变说明NO2的浓度保持恒定;
c、反应2NO2(g)?N2O4(g)气压恒定时,正、逆反应速率相等;
③反应为放热反应,升高温度,K值减小,计算可知此时的浓度商Q=K(298K)>K(398K),反应向逆反应方向移动,因此V(正)<V(逆);
(3)依据题给的信息得知CaF2和MgF2的溶度积分别是钙离子的浓度与氟离子浓度的平方和镁离子的浓度与氟离子浓度的平方,故据此转化为求两者的溶度积之比即可;
(4)通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,原子守恒与电荷守恒可知,还原生成H+,配平书写为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.
解答 解:(1)1g燃料完全燃烧释放出的能量为42.5kJ,则1mol偏二甲肼完全燃烧释放出的能量为42.5kJ×60=2550kJ,其热化学方程式为:C2H8N2(l)+2N2O4(l)═2CO2(g)+3N2(g)+4H2O(l)△H=-2550 kJ/mol,
故答案为:C2H8N2(l)+2N2O4(l)=2CO2(g)+3N2(g)+4H2O(l)△H=-2550 kJ•mol-1;
(2)①有图可知N2O4的平衡浓度为0.6mol/L,达到平衡时,N2O4的浓度为NO2的2倍,则NO2的平衡浓度为0.3mol/L,则K=$\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$=$\frac{0.6mol/L}{(0.3mol/L)^{2}}$=6.67L/mol,
故答案为:6.67;
②a、反应物和生成物全是气态物质,气体的质量不变,容积为2L保持恒定,由ρ=$\frac{m}{V}$可知气体的密度为一定值,因此气体的密度保持不变不一定处于平衡状态,故a选;
b、混合气体的颜色不变说明NO2的浓度不变,说明反应处于化学平衡状态,故b不选;
c、反应2NO2(g)?N2O4(g)是一个气体体积减小的反应,气压恒定时,正、逆反应速率相等,说明反应处于化学平衡状态,故c不选;
故答案为:a;
③反应为放热反应,升高温度,K值减小,密闭容器的体积为2L,因此的N2O4的浓度为0.6mol/L,NO2的浓度为0.3mol/L,浓度商Q=$\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$=$\frac{0.6mol/L}{(0.3mol/L)^{2}}$=6.67L/mol=6.67L/mol=K(298K)>K(398K),反应向逆反应方向移动,因此V(正)<V(逆);
故答案为:<;
(3)$\frac{c(C{a}^{2+})}{c(M{g}^{2+})}$=$\frac{c(C{a}^{2+})c({F}^{-})}{c(M{g}^{2+})c({F}^{-})}$=$\frac{1.11×1{0}^{-10}}{7.40×1{0}^{-11}}$=1.5,故答案为:1.5;
(4)通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;
以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,结合原子守恒与电荷守恒可知,还原生成H+,配平书写离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+,故答案为:Co2+-e-=Co3+;6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.
点评 本题考查知识点全面,涉及热化学方程式的书写、平衡常数的计算、平衡的移动、电化学的原理和离子方程式的书写等知识,属于综合知识的考查,题目难度中等.

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案| A. |  浓硫酸稀释 | B. |  除去氯气中氯化氢 | ||
| C. |  点燃 | D. |  转移溶液 |
| A. | 洗净的滴定管和容量瓶可以放进烘箱中烘干 | |
| B. | 用10mL量筒量取10.00mLNaCl溶液 | |
| C. | 酸式滴定管装标准溶液前,必须先用该溶液润洗2~3次 | |
| D. | 用容量瓶配溶液时,若加水超过刻度线,立即用滴管吸出多余液体 |
| A. | 碱金属的单质中,锂的还原性最强 | |
| B. | 第ⅠA族元素比第ⅡA族元素的金属性强 | |
| C. | 随着核电荷数的递增,卤族元素的气态氢化物的稳定性逐渐减弱 | |
| D. | 随着核电荷数的递增,第三周期元素的氧化物对应的水化物的酸性逐渐增强. |
| A. | pH=2的溶液中:NH4+、Na+、Cl-、Cu2+ | |
| B. | 加入KSCN显红色的溶液:K+、NH4+、Cl-、CO32- | |
| C. | 无色溶液中:K+、CH3COO-、HCO3-、MnO4- | |
| D. | 含有大量NaClO的水溶液中:Fe2+、Cl-、Ca2+、Na+ |
(1)如用下图I装置制取氨气,可选择的试剂是浓氨水与氢氧化钠固体(或浓氨水与碱石灰或浓氨水与生石灰).
(2)制备氨基甲酸铵的装置如图Ⅱ所示,把NH3和CO2通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵的小晶体悬浮在CCl4中. 当悬浮物较多时,停止制备.
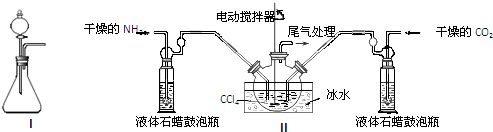
注:CCl4与液体石蜡均为惰性介质.
①发生器用冰水冷却的原因是降低温度,提高反应物转化率(或降低温度,防止因反应放热造成产物分解).液体石蜡鼓泡瓶的作用是通过观察气泡,调节NH3与CO2通入比例(或通过观察气泡,控制NH3与CO2的反应速率).
②从反应后的混合物中分离出产品的实验方法是过滤(填写操作名称).为了得到干燥产品,应采取的方法是C(填写选项序号).
a.常压加热烘干 b.高压加热烘干 c.减压40℃以下烘干
(3)制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种.
①设计方案,进行成分探究.
限选试剂:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、稀盐酸.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解. | 得到无色溶液 |
| 步骤2:向试管中加入过量的BaCl2溶液,静置 | 溶液不变浑浊,证明固体中不含碳酸铵. |
| 步骤3:向试管中继续加入少量澄清石灰水. | 溶液变浑浊,证明固体中含有碳酸氢铵. |
[保留两位有效数字,已知Mr(NH2COONH4)=78、Mr(NH4HCO3)=79、Mr(BaCO3)=197].
| A. | 聚氯乙烯塑料制品可用于食品包装 | |
| B. | H7N9型禽流感病毒在高温条件下被杀死的过程是蛋白质变性 | |
| C. | 高纯度的硅单质用于制作光导纤维,光导纤维有导电性 | |
| D. | 研发使用高效催化剂,可提高反应中原料的转化率 |
| A. | BaSO4?Ba2++SO42- | B. | HF═H++F- | ||
| C. | HI?H++I- | D. | NaHCO3═Na++HCO3- |
 )与丙烯的共聚物是一种高分子阻燃剂,具有低毒、热稳定性好等优点.完成下列填空:
)与丙烯的共聚物是一种高分子阻燃剂,具有低毒、热稳定性好等优点.完成下列填空: 或
或 .
. .
. 与氢氧化钠溶液共热得到A,A在酸性条件下遇FeCl3溶液不显色.A的结构简式为
与氢氧化钠溶液共热得到A,A在酸性条件下遇FeCl3溶液不显色.A的结构简式为 .由A生成对溴苯乙烯的反应条件为浓硫酸、加热.
.由A生成对溴苯乙烯的反应条件为浓硫酸、加热.