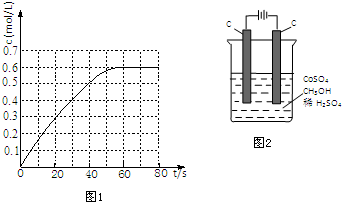
题目内容
19.下列有关仪器使用方法或实验操作正确的是( )| A. | 洗净的滴定管和容量瓶可以放进烘箱中烘干 | |
| B. | 用10mL量筒量取10.00mLNaCl溶液 | |
| C. | 酸式滴定管装标准溶液前,必须先用该溶液润洗2~3次 | |
| D. | 用容量瓶配溶液时,若加水超过刻度线,立即用滴管吸出多余液体 |
分析 A.容量瓶不需要干燥;
B.量筒的感量为0.1mL;
C.滴定管需要润洗;
D.加水超过刻度线,实验失败.
解答 解:A.容量瓶不需要干燥,而滴定管可以放进烘箱中烘干,故A错误;
B.量筒的感量为0.1mL,则用10mL量筒量取10.0mLNaCl溶液,故B错误;
C.滴定管需要润洗,则酸式滴定管装标准溶液前,必须先用该溶液润洗2~3次,故C正确;
D.加水超过刻度线,实验失败,应重新配制,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握仪器的使用、实验基本操作等等为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
9.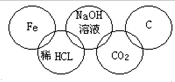 某同学在奥运五连环中填入了5种物质,相连环物质间能发生反应,不相连间不能发生反应.你认为在“五连环”物质的反应中,属于氧化还原反应的有几个,哪种基本反应类型没有涉及到( )
某同学在奥运五连环中填入了5种物质,相连环物质间能发生反应,不相连间不能发生反应.你认为在“五连环”物质的反应中,属于氧化还原反应的有几个,哪种基本反应类型没有涉及到( )
 某同学在奥运五连环中填入了5种物质,相连环物质间能发生反应,不相连间不能发生反应.你认为在“五连环”物质的反应中,属于氧化还原反应的有几个,哪种基本反应类型没有涉及到( )
某同学在奥运五连环中填入了5种物质,相连环物质间能发生反应,不相连间不能发生反应.你认为在“五连环”物质的反应中,属于氧化还原反应的有几个,哪种基本反应类型没有涉及到( )| A. | 1个、复分解反应 | B. | 2个、分解反应 | C. | 3个、化合反应 | D. | 2个、置换反应 |
10.在一定温度下体积固定的密闭容器中,当下列物理量:①混合气体的压强②混合气体的平均摩尔质量③混合气体的密度④A的物质的量浓度:均不再变化时,能表明可逆反应A(s)+2B(g)?C(g)+D(g)已达平衡的是( )
| A. | ①② | B. | ②③ | C. | ①④ | D. | 只有④ |
7.下列装置应用于实验室制氯气并回收氯化锰的实验,不能达到实验目的是( )
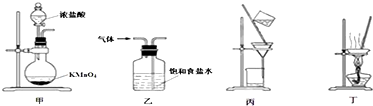

| A. | 用装置甲制取氯气 | |
| B. | 用装置乙除去氯气中的少量氯化氢 | |
| C. | 用装置丙分离二氧化锰和氯化锰溶液 | |
| D. | 用装置丁蒸发浓缩氯化锰溶液,冷却可得MnCl2•4H2O晶体 |
9.对于可逆反应M+N?Q 达到平衡时,下列说法中,正确的是( )
| A. | M、N全部变成了Q | |
| B. | M、N、Q三种物质的浓度一定相等 | |
| C. | 反应已经停止 | |
| D. | 反应混合物各成分的百分组成不再变化 |
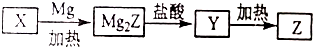
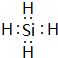 .
.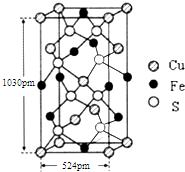 黄血盐(亚铁氰化钾,K4[Fe(CN)6])易溶于水,广泛用作食盐添加剂(抗结剂),食盐中黄血盐的最大使用量为10mg•kg-1.黄血盐经长时间火炒,超过400℃时会分解生成剧毒的氰化钾.回答下列问题:
黄血盐(亚铁氰化钾,K4[Fe(CN)6])易溶于水,广泛用作食盐添加剂(抗结剂),食盐中黄血盐的最大使用量为10mg•kg-1.黄血盐经长时间火炒,超过400℃时会分解生成剧毒的氰化钾.回答下列问题: