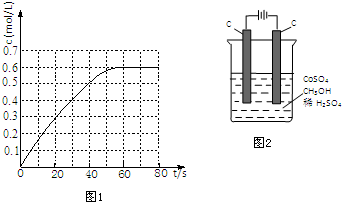
题目内容
16.下列各组离子在指定溶液中能大量共存的是( )| A. | pH=2的溶液中:NH4+、Na+、Cl-、Cu2+ | |
| B. | 加入KSCN显红色的溶液:K+、NH4+、Cl-、CO32- | |
| C. | 无色溶液中:K+、CH3COO-、HCO3-、MnO4- | |
| D. | 含有大量NaClO的水溶液中:Fe2+、Cl-、Ca2+、Na+ |
分析 A.pH=2的溶液中存在大量氢离子,四种离子之间不反应,都不与氢离子反应;
B.加入KSCN显红色的溶液中存在铁离子,铁离子与碳酸根离子发生双水解反应;
C.高锰酸根离子为有色离子,不满足溶液无色的条件;
D.次氯酸钠能够氧化亚铁离子.
解答 解:A.pH=2的溶液为酸性溶液,溶液中存在大量氢离子,NH4+、Na+、Cl-、Cu2+之间不反应,都不与氢离子反应,在溶液中能够大量共存,故A正确;
B.加入KSCN显红色的溶液中存在铁离子,Fe3+与CO32-发生双水解反应,在溶液中不能大量共存,故B错误;
C.MnO4-为有色离子,在溶液中不能大量共存,故C错误;
D.NaClO、Fe2+之间发生氧化还原反应,在溶液中不能大量共存,故D错误;
故选A.
点评 本题考查离子共存的判断,为高考的高频题,题目难度中等,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在等,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
6.下列反应属于吸热反应的是( )
| A. | 浓硫酸溶于水 | B. | 钠与水反应 | C. | 生石灰溶于水 | D. | 氯化铵加热分解 |
7.下列装置应用于实验室制氯气并回收氯化锰的实验,不能达到实验目的是( )
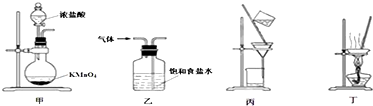

| A. | 用装置甲制取氯气 | |
| B. | 用装置乙除去氯气中的少量氯化氢 | |
| C. | 用装置丙分离二氧化锰和氯化锰溶液 | |
| D. | 用装置丁蒸发浓缩氯化锰溶液,冷却可得MnCl2•4H2O晶体 |
1.超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层.科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$2CO2(g)+N2(g)△H<0
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)前2s内的平均反应速率υ(N2)=1.9×10-4mol/(L•s);CO的平衡转化率为25%.(结果均保留两位有效数字)
(2)写出该反应的平衡常数K的表达式$\frac{{c}^{2}(C{O}_{2})×c({N}_{2})}{{c}^{2}(NO)×{c}^{2}(CO)}$.
(3)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是CD.
A.选用更有效的催化剂B.升高反应体系的温度
C.降低反应体系的温度D.缩小容器的体积
(4)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.某同学设计了三组实验,实验条件已经填在下面实验设计表中.
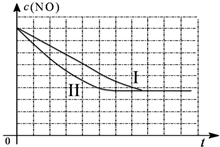
①以上三组实验的实验目的是分别验证温度、催化剂比表面积对化学反应速率的影响规律.
②请在给出的坐标图中,画出上表中的第三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图.
(5)已知CO的燃烧热为284kJ/mol,且N2(g)+O2(g)═2NO(g)△H=+180kJ/mol;则反应2NO(g)+2CO(g)?2CO2(g)+N2(g)△H=-748kJ/mol.
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) (mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO) (mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(1)前2s内的平均反应速率υ(N2)=1.9×10-4mol/(L•s);CO的平衡转化率为25%.(结果均保留两位有效数字)
(2)写出该反应的平衡常数K的表达式$\frac{{c}^{2}(C{O}_{2})×c({N}_{2})}{{c}^{2}(NO)×{c}^{2}(CO)}$.
(3)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是CD.
A.选用更有效的催化剂B.升高反应体系的温度
C.降低反应体系的温度D.缩小容器的体积
(4)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.某同学设计了三组实验,实验条件已经填在下面实验设计表中.
| 实验 编号 | T(℃) | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的比表面积 (m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
| Ⅲ | 350 | 1.20×10-3 | 5.80×10-3 | 124 |
②请在给出的坐标图中,画出上表中的第三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图.

(5)已知CO的燃烧热为284kJ/mol,且N2(g)+O2(g)═2NO(g)△H=+180kJ/mol;则反应2NO(g)+2CO(g)?2CO2(g)+N2(g)△H=-748kJ/mol.
5.下列溶液中微粒浓度关系一定正确的是( )
| A. | 室温下,氨水与氯化铵的pH=7的混合溶液中:c(Cl-)=c(NH4+) | |
| B. | 向NaHCO3溶液中加入少量NaOH固体,可抑制HCO3-的水解,使c(HCO3-)增大 | |
| C. | 0.1 mol•L-1的(NH4)2SO4溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) | |
| D. | 常温下,等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和时,a+b=14 |
6.常温下,某溶液中由水电离的[H+]和[OH-]的乘积为1.0×10-22 mol2•L-2,则在该溶液中一定不能大量共存的离子组是( )
| A. | Al3+、Na+、NO3-、Cl- | B. | K+、Na+、Cl-、CO32- | ||
| C. | NH4+、Na+、Cl-、SO42- | D. | NH4+、K+、SiO32-、NO3- |
 黄血盐(亚铁氰化钾,K4[Fe(CN)6])易溶于水,广泛用作食盐添加剂(抗结剂),食盐中黄血盐的最大使用量为10mg•kg-1.黄血盐经长时间火炒,超过400℃时会分解生成剧毒的氰化钾.回答下列问题:
黄血盐(亚铁氰化钾,K4[Fe(CN)6])易溶于水,广泛用作食盐添加剂(抗结剂),食盐中黄血盐的最大使用量为10mg•kg-1.黄血盐经长时间火炒,超过400℃时会分解生成剧毒的氰化钾.回答下列问题: